Hypothèse hygiéniste : abstract du livre de Rook.
dernière mise à jour le 29/03/2023
De façon synthétique, l’hypothèse hygiéniste suggère que la récente augmentation des troubles inflammatoires chroniques est en partie attribuable à la dérégulation immunitaire, résultant du manque d’exposition aux micro-organismes qui ont joué un rôle essentiel dans la mise en place de notre système immunitaire.
Ce document discute les propositions suivantes:
- Le rôle essentiel de ces organismes est de fournir un exemple de dépendance évoluée.
- Les organismes les plus importants sont ceux qui ont co-évolué avec les mammifères et accompagné les premiers hominidés du paléolithique.
- Les plus récentes des maladies infectieuses pédiatriques n’ont probablement pas joué ce rôle, comme le confirment les données épidémiologiques récentes.
- Ce mécanisme interagit avec d’autres modifications environnementales modernes qui conduisent également à augmenter les réponses inflammatoires (régimes inappropriés, obésité, stress, déficit en vitamine D, pollution par les dioxines, etc.).
- Le registre des troubles inflammatoires chroniques concernés est potentiellement plus grand que ce qui est habituellement supposé (allergies, maladies auto-immunes, MICI, mais aussi maladies cardio-vasculaires, certains cancers, anxiété et dépression lorsqu’il y a un taux élevé de cytokines inflammatoires, et peut-être maladies neuro-dégénératives et DT2).
Introduction
La perspicacité de Darwin nous aide de plus en plus à combler nos espoirs de comprendre les maladies de l’homme, et l’hypothèse hygiéniste devient l’un des éléments majeurs de la « médecine darwinienne ».
Il faut cependant s’interroger sur un étonnant paradoxe : la recherche des termes “médecine darwinienne” et « médecine évolutionniste » par Google en mars 2009, donnait respectivement 22 200 et 32 100 réponses. Cependant, ces termes n’existent pas dans la base MeSH ; ainsi les recherches sur PUBMED n’indiquent qu’une poignée de publications. Ceci peut refléter le peu d’intérêt que porte l’establishment médical à l’individualisation du concept de médecine évolutionniste, et constitue plus certainement un échec dans la reconnaissance de l’hypothèse hygiéniste, comme l’un de ses thèmes majeurs.
L’évolution transforme l’inévitable en nécessité
La science biomédicale actuelle commence doucement à admettre l’évidence de l’implication d’organismes spécifiques (par exemple, le virus de l’hépatite A, la flore intestinale et les helminthes) dans la régulation de notre système immunitaire. Cependant, si nous raisonnons sur un mode Darwinien, nous devons partir de l’hypothèse, que tout organisme dont la présence a été constante pendant une grande partie de l’évolution des mammifères, a été inscrit dans leur génome, car « l’évolution transforme l’inévitable en nécessité » ; ou en termes plus simples, tout ce qui a été toujours été là doit continuer à être là. (Prenons l’exemple extrême de l’oxygène à laquelle certains organismes se sont adaptés lorsqu’elle est apparue sur terre, et dont ils ne peuvent désormais plus se passer.)
Les bactéries ont été parmi les premières formes vivantes, et le plus récent ancêtre commun des bactéries modernes existait il y a deux ou trois milliards d’années. Les premiers vertébrés (environ 500 millions d’années) et les premiers mammifères (environ 200 millions d’années) ont évolué dans un monde où il y avait déjà un million de bactéries dans chaque ml d’eau, dix millions dans chaque gramme de terre, et sans doute autant sur leur peau et dans leur intestin. Les cellules de mammifères proviennent, à l’évidence, de toute une série d’endosymbioses.
Dépendance initiale, dépendance évolutive ou exploitation ?
Comme tous les animaux multicellulaires complexes ont évolué avec la présence continue de micro-organismes, certains de ces organismes ont dû remplir des fonctions pour le système immunitaire qui n’ont jamais été encodées par le génome des mammifères, tout simplement parce qu’elles n’avaient jamais besoin de l’être. Nous pouvons nommer ceci une « dépendance initiale », car ces organismes, présents dès le début de l’évolution du système immunitaire, devinrent des composants essentiels de ce système. Par exemple, les niveaux de base de polysaccharides microbiens, de lipopolysaccharides, de phospholipides et de glycopeptides, sont des signaux probables de mise en place d’un système immunitaire.
Dans d’autres cas, il y aura une “dépendance évoluée”. Ce terme fait le plus souvent référence à des situations où un organisme s’est adapté à la présence d’un partenaire en perdant du matériel génétique ; il ne peut donc plus fonctionner sans ce partenaire. [1]. Un exemple classique a été observé en laboratoire lors de l’infection d’une souche d’Amoeba discoïdes par une bactérie [2]. Au départ, il n’y eut pas de mutualisme, car cette infection compromit la croissance des deux espèces. Cependant, au bout de cinq ans, on constata qu’aucun des deux organismes ne pouvait survivre sans l’autre. Preuve d’une modification génétique conduisant à la dépendance. Par exemple, une enzyme codée par le génome des deux espèces, peut conduire l’une des deux à une perte du gène codant, l’accès à ce gène étant désormais confié à l’autre espèce. Cette idée semble, de prime abord, étrange aux immunologistes, mais en fait, elle est banale. Par exemple, la plupart des mammifères peuvent synthétiser la vitamine C, mais les grands singes et les cobayes en ont perdu la capacité. L’homme et le cobaye sont désormais dépendants des fruits et des légumes ; nous possédions les gènes dans le passé, mais nous ne les avons plus. Le meilleur exemple de dépendance évoluée est celui des mitochondries dont le génome est très proche de celui des Rickettsies, mais qui a perdu beaucoup de matériel génétique.
Logiquement, il pourrait y avoir aussi des situations où un micro-organisme récemment muté ou récemment rencontré, offre une fonction ou une molécule apportant de nouvelles possibilités qui finissent par compter pour l’hôte. On pourrait appeler cela une « dépendance d’exploitation ». Elle n’est probablement pas commune, mais nous devrions en trouver des exemples.
Ces trois types de dépendance doivent être distingués des situations où une infection extermine un sous-groupe de population, comme cela est manifestement arrivé dans le passé. Il ne s’agit évidemment pas d’une dépendance, mais si ce même sous-groupe était particulièrement sensible à un trouble inflammatoire chronique d’apparition à un âge tardif, ce mécanisme conduirait vite à un changement de répartition des maladies. Et la fréquence de ces gènes de susceptibilité diminuerait rapidement.
De plus, les modifications de mortalité ayant été faibles dans les dernières décennies, alors que l’augmentation des troubles inflammatoires chroniques a été très importante, ce dernier mécanisme ne peut expliquer les récents changements qui ont conduit à élaborer l’hypothèse hygiéniste. Il nous faut maintenant identifier les organismes dont notre système immunitaire est probablement dépendant.
Environnement de l’adaptation évolutive (EEA)
Ce terme (EEA) a été utilisé pour la première fois par John Bowlby en 1969, alors qu’il se demandait si les aspects génétiquement déterminés du comportement humain (comme les instincts) étaient plus adaptés au mode de vie des chasseurs-cueilleurs qu’à ceux des cités modernes [3]. Depuis le début de l’agriculture et du pastoralisme, il y a environ 10 000 ans, l’adaptation humaine à ce nouvel environnement a été plus culturelle et technologique que génétique. (De façon intéressante, la diversité génétique humaine semble augmenter plus rapidement qu’auparavant, mais ceci est davantage dû à l’explosion démographique qu’à l’adaptation à des environnements spécifiques [4].) Par exemple, nous n’avons pas eu d’adaptation génétique pour vivre dans le froid : nous avons appris à faire des manteaux de fourrure. Les hommes détectent facilement les incompatibilités gène-environnement de leur environnement physique et inventent des moyens technologiques d’adaptation. Cependant, le système immunitaire est incapable de fournir à notre conscience claire qu’il reçoit des stimuli microbiens inadéquats ; ainsi, nous n’avons pas été conscients de ce problème et nous n’avons pas vu les solutions. Ce n’est que depuis l’émission de l’hypothèse hygiéniste, que nous avons commencé à nous demander si le système immunitaire des citoyens des villes propres et modernes recevait des informations appropriées.
Au regard de l’évolution humaine, nous considérons que l’environnement principal de l’adaptation humaine est celui des chasseurs-cueilleurs du paléolithique.
Voici, résumés en 6 périodes de longueur inégale, les différents environnements de l’homme.  (figure 1)
(figure 1)
I/ Dans le passé lointain :
A l’époque des premiers hominidés, ceux-ci vivaient en petits groupes épars. Les micro-organismes de leur environnement étaient les saprophytes (mycobactéries, dietzia, tsukamurella, gordonia), des molécules microbiennes, des lipopolysaccharides, des glycopeptides. Ainsi que toutes les espèces du patrimoine légué par nos ancêtres, telles que la flore intestinale .
II/ Au Paléolithique (entre - 2,5 millions - 10 000 ans) :
Les espèces du genre homo se répartissaient en groupes constitués d’une centaine de chasseurs-cueilleurs vivant près des lacs et rivières. Ils mangeaient des charognes et buvaient des boissons fermentées. Les micro-organismes de leur environnement comprenaient de nombreux helminthes, dont les oxyures. Des virus ayant probablement co-évolué avec l’homme (herpès, papilloma, adénovirus, parvovirus, hépatite A, entérovirus). Des bactéries telles que Helicobacter pylori, salmonelles, staphylocoques, des formes primitives de BK. Des toxoplasmes, pneumocystis et lactobacilles de fermentation.
La première transition épidémiologique est celle du passage au néolithique.
III / Au Néolithique (entre -10 000 et - 3 000 ans) :
Homo sapiens vit en groupes sociaux de plus grande taille. Il pratique l’élevage et a des contacts prolongés avec plusieurs animaux. Il a des chats et chiens domestiques, et vit proche des rongeurs parasites. Il y a plus de contamination fécale et une augmentation de la transmission oro-fécale en raison de la grande taille des groupes. Les virus de l’environnement sont : calicivirus, rotavirus, coronavirus, orthomyxovirus (influenza A et B), paramyxovirus (rougeole, oreillons, parainfluenza), variole. L’évolution microbienne est rapide dans de nouvelles niches écologiques. Il y a des modifications des cycles des helminthes entre hommes et animaux. Apparition du choléra, de la peste et du typhus.
IV/ Âge de bronze (entre -3 000 et - 1 500) :
Certaines cités ont plus de 200 000 habitants. Influenza B et C, rougeole, variole, oreillons et peste commencent à devenir endémiques en certaines régions.
V/ Âge de fer (entre -1 500 et +1 800) :
97% de l’humanité vit encore en environnement rural. Dans les fermes, le contact avec les animaux, la terre et la boue est permanent. Les eaux de boisson ne sont pas traitées. La peste et le choléra surviennent par épidémies. Cependant, le mode d’exposition quotidienne aux micro-organismes présente assez peu de changement par rapport au néolithique.
Survient alors la deuxième grande transition épidémiologique avec le passage au monde moderne et citadin.
VI/ Monde moderne (de 1 800 à nos jours) :
Les villes deviennent des mégalopoles. Le revêtement des sols limite fortement le contact avec la terre et les boues. L’eau de boisson est purifiée par le chlore. Les aliments sont lavés. Apparition des savons et détergents. Diminution rapide de la transmission oro-fécale. Moins de contacts animaux. Apparition des antibiotiques et des vermifuges. Arrêt brutal de l’exposition aux saprophytes environnementaux, disparition des helminthes, moins de micro-organismes à transmission oro-fécale (salmonelles, hélicobacter pylori, hépatite A). Moins de toxoplasmose. Perte des AOB (ammonia oxidizing bacteria) de notre peau (bactéries nitrifiantes par oxydation de l’ammonium). Moins d’exposition à la flore microbienne d’autres individus. Perturbations intermittentes de la flore microbienne par les antibiotiques.
L’hypothèse
Ces principaux aspects de l’histoire microbiologique de l’humanité que nous venons de passer en revue, sont les plus pertinents pour l’hypothèse hygiéniste. Les données épidémiologiques, les modèles animaux de laboratoire et les premiers essais cliniques sur cette hypothèse, impliquent plusieurs des organismes (ceux qui sont écrits en gras), supposés avoir accompagné l’évolution des mammifères et de l’homme. Cette relation a été assez longue pour permettre l’établissement de dépendances évolutives. Les organismes apparus au néolithique sont probablement moins intéressants dans ce contexte, et la première transition épidémiologique n’a pas réduit le contact avec les micro-organismes associés aux animaux, aux matières fécales et aux boues de la période paléolithique. Inversement, la seconde transition épidémiologique peut avoir conduit à une incompatibilité gène-environnement, lorsque nos « vieux amis » du paléolithique ont progressivement disparu de l’environnement moderne.
Cette prédominance en durée, d’une exposition de type paléolithique et néolithique, nous permet-il de définir les rencontres microbiennes que notre système immunitaire s’attend à faire, car il a évolué avec ? Le mode de vie des chasseurs-cueilleurs était en fait différent, car les environnements différaient. Il s’agit donc d’un problème complexe, et c’est la raison pour laquelle le EEA concept est souvent critiqué [5,6]. Néanmoins, on peut identifier des types de micro-organismes qui ont été abondants dans toutes les manifestations de l’EEA humain, mais qui ont brutalement diminué ou disparu de l’environnement des cités modernes.
Transitions épidémiologiques
Ces points soulignent le besoin de comprendre les changements de l’exposition de l’homme aux micro-organismes.
En 1971, Omran consacra le terme de “ transition épidémiologique” pour décrire les tournants majeurs du développement humain qui ont conduit à d’importants changements dans la mortalité [7,8]. Les populations du paléolithique ont porté les micro-organismes hérités de leurs ancêtres primates : véritables espèces patrimoniales. Celles-ci comptaient de multiples helminthes, et les virus qui ont très probablement co-évolué avec l’homme (herpès, papilloma, adénovirus, parvovirus, picornavirus comme les entérovirus, hépatite A et peut-être hépatite B) [9,10] ; d’autres organismes importants comme Helicobacter pylori, oxyures, Pneumocystis, Salmonelles, Staphylocoques et probablement les formes primitives du BK) [6,8,9,11–13]. Ils ont été également exposés à des zoonoses en se nourrissant de charognes [6,8]. Chaque jour, ils ont donc consommé plusieurs milligrammes de saprophytes inoffensifs et omniprésents dans l’eau et le sol. Nommons-les des “pseudo-commensaux”, en raison de leur présence ubiquitaire et continue jusqu’à un passé très récent. Tous ces organismes sont d’excellents candidats pour la pertinence de l’hypothèse hygiéniste, en raison de leur très long voisinage avec l’homme, qui en était le plus souvent un porteur sain. De façon très contrastée, la densité démographique était trop faible pour qu’apparaissent des épidémies et endémies dangereuses, qui ne soient donc pas des états de portage.
Il y a environ 10 000 ans, le passage à l’agriculture et à l’élevage constitua la première transition épidémiologique [7,8]. Celle-ci aura un petit effet sur l’exposition aux pseudo-commensaux et aux espèces patrimoniales. Cependant, le mode de vie plus sédentaire augmenta la transmission oro-fécale et prolongea les contacts avec les animaux. Ces derniers entraînèrent l’adaptation à l’homme de nombreux virus animaux, tels que calicivirus, rotavirus, coronavirus, orthomyxovirus (influenza B et C), paramyxovirus (rougeole, oreillons, parainfluenza, variole). Certains d’entre eux, comme les calicivirus et rotavirus, pourraient avoir été présents chez les premiers hominidés, ou au moins rencontrés lors de zoonoses sporadiques, mais les souches humaines usuelles montrent d’étroites relations avec celles des bovins et porcins, suggérant une évolution plus marquée au néolithique. [9]. Sans doute, les plus grands groupes humains sédentarisés fournirent un nouvel habitat microbien qui conduisit à une véritable explosion de l’évolution microbienne [14]. Dans les pays développés, pratiquement tous les enfants sont séropositifs au rotavirus. D’autres virus, probablement acquis au néolithique, tels que influenza (B and C), variole, rougeole et oreillons, ne sont pas devenus endémiques avant que les populations aient une taille assez importante. Il fallait des communautés de plusieurs milliers de personnes, ce qui n’arriva qu’avec les premières cités, il y a environ 3 000 ans. Comme ceci ne représente que 100 à 150 générations, il aurait fallu une pression sélective extraordinairement forte pour qu’apparaisse une dépendance évoluée, et cela semble très improbable. De plus, la plupart des humains ne vivaient pas en groupes si nombreux, et ces virus étaient, par exemple, absents chez les peuples américains précolombiens. Au mieux, ces infections ont éliminé quelques génotypes susceptibles. Les infections sporadiques et de courte durée n’ont jamais conduit à une dépendance évoluée.
Il est intéressant de noter que, pendant cette période néolithique, l’homme a aussi transmis certaines de ses infections à ses animaux domestiques. C’est le cas de quelques helminthiases [6] et de la tuberculose bovine, dont les souches sont dérivées de celles de l’homme, et non l’inverse. [13].
En résumé, il y eut de spectaculaires changements dans l’environnement microbien de l’homme après la première transition épidémiologique, mais ils n’ont pas conduit à une baisse d’exposition aux organismes impliqués dans l’épidémiologie de l’hypothèse hygiéniste (ceux qui ont été écrits en gras), parce que jusqu’à l’époque moderne, plus de 97% de la population humaine vivait encore en environnement rural, près des boues, des animaux et des matières fécales qui sont les sources de ces organismes. Cette situation n’a pas changé jusqu’au milieu du XIX° siècle.
A partir du milieu de XIX° siècle, quelques populations ont subi une seconde transition épidémiologique au cours de laquelle les mesures de santé publique et, plus récemment, les antibiotiques, ont abouti à une diminution (ou un retard) d’exposition à la plupart des organismes qui étaient présents aux âges antérieurs.
Les changements de notre environnement microbiologique, lors de cette seconde transition, sont ceux qui contribuent à l’augmentation des désordres inflammatoires chroniques.
Moyens de modification de l’exposition microbienne
Ces changements peuvent consister, soit en une élimination du micro-organisme, soit en une modification de dose de l’organisme ou de ses composants, soit en un retard de contamination. L’élimination de la plupart des helminthes et celle du HAV sont bien documentées [15]. Un changement de dose de composant microbien peut changer le type des lymphocytes guidés par ses effets adjuvants. Par exemple, les doses de lipopolysaccharides (LPS), dsRNA ou Chlamydia pneumoniae, déterminant si les T helper de type 2 (Th2) augmentent ou diminuent [16]. Un retard d’infection peut être crucial, car il survient après une décroissance du taux d’anticorps acquis de la mère. Par exemple, l’hépatite A, inoffensive chez les nourrissons, est souvent fatale après la cinquantaine [10]. Un sujet de grande importance aujourd’hui est de savoir si l’âge d’apparition des infections virales est déterminant dans l’augmentation du diabète de type 1 [17,18]. De la même façon, une hypothèse attribue la rapide augmentation des cas de leucémie aiguë lymphoblastique chez les enfants à un retard d’infection par un organisme non encore identifié [19].
Les organismes impliqués dans l’hypothèse hygiéniste
Dans une perspective darwinienne, nous devons nous attendre à ce que les micro-organismes aptes à confirmer l’hypothèse hygiéniste, aient été présents, inévitablement et de façon continue, dès le début de l’évolution de notre système immunitaire (de « vieux amis »). On voudrait également trouver un mode fiable de transmission tel que le mode oro-fécal, accompagné d’une capacité à établir un portage sain afin de faciliter une telle transmission. Finalement, les organismes les plus pertinents pourraient être des commensaux résidant en permanence dans l’intestin (comme cela est désormais bien établi [20]), ou la flore cutanée normale [21], ou des organismes assez abondants dans l’environnement pour devenir des « pseudo-commensaux », consommés inévitablement et régulièrement en quantité de l’ordre du milligramme. Nous avons déjà vu la liste de ces organismes qui ont accompagné l’homme du paléolithique, et nous avons écrit en gras, ceux dont la réduction est déjà impliquée par l’épidémiologie de l’hypothèse hygiéniste.
“Vieux amis”, pseudo-commensaux et transmission oro-fécale
Nous ne discuterons ici que quelques exemples illustratifs. Les organismes à transmission oro-fécale impliqués dans les récentes études épidémiologiques de l’hypothèse hygiéniste sont particulièrement instructifs [15,22–25]. La diversité génétique de Helicobacter Pylori décroît avec l’éloignement de l’Afrique de l’Est, où les hommes modernes ont évolué, et comme les humains, H. Pylori semble s’être propagé à partir de l’Afrique de l’Est, il y a environ 58 000 ans [26]. De la même façon, Salmonella est un organisme ancien (≈50 000 ans), donnant volontiers lieu à des portages sains [8,11]. Les entérovirus et le HAV sont des picornavirus qui, comme la plupart des virus de ce groupe, ont probablement suivi une spéciation parallèle à celle des singes du Vieux Monde et des humains [9]. Le HAV est stable et résiste à l’inactivation par l’environnement [10], et son implication dans l’hypothèse hygiéniste est expliquée en détail dans cet article [15]. Dans les pays développés, ce virus est omniprésent, et les nourrissons sont infectés avant l’âge de 3 ans. Toxoplasma gondii est un parasite protozoaire dont le cycle vital est complexe, impliquant une reproduction sexuée chez les chats et une propagation asexuée chez presque tous les mammifères (à l’exception des baleines et des chauves-souris), ainsi que chez les marsupiaux et les oiseaux. Cependant, les formes kystiques peuvent se transmettre aux carnivores, omnivores et charognards, sans passer par la phase sexuelle chez un félidé. Ainsi, la transmission à l’homme a probablement été très fréquente avant le néolithique, avec une possible augmentation au début de l’élevage et de la domestication du chat. [27]. D’autres protozoaires, non encore étudiés dans notre propos, tels que les très anciens Entamoeba, Giardia et Trichomonas, ont perdu leur mitochondrie et sont intimement associés à l’homme.
Flore intestinale commensale
Le rôle immunologique de la flore intestinale et ses changements dus au régime, à l’hygiène et aux antibiotiques, sont déjà acceptés par tous et n’ont plus besoin d’être discutés ici [28], même si le sujet mérite d’être développé. Une étude récente nous apprend que des manipulations du système immunitaire interviennent parfois par le biais de changements du microbiote intestinal. Les souris diabétiques non obèses ont une destruction auto-immune spontanée des cellules β du pancréas. Ceci ne se produit pas chez les souris où le gène MyD88 (codant la différenciation de la lignée myéloïde) est inactivé, suggérant un rôle direct du MyD88 dans la réponse immunitaire des lymphocytes T aux cellules β. Cependant, cette interprétation se révéla incorrecte. L’inactivation du MyD88 entraîne des modifications importantes du microbiote intestinal, et cette flore perturbée inhibait le processus auto-immun qui n’était pas inhibé chez des souris au gène inactivé mais avec l’intestin stérile. [29]. Si cela est correct, de nombreuses recherches immunologiques par « knock-out » génétique devront être réinterprétées. Combien de changements de phénotypes constatés ont été secondaires à des modifications de la flore intestinale ? Pour le moins, cette expérience met en lumière la très étroite relation entre le microbiote et le système immunitaire. Les changements majeurs de notre mode de vie et de notre régime, ainsi que l’utilisation des antibiotiques, doivent avoir de l’importance. Le rôle des intestins dans la régulation immunitaire a été déjà étudié [30].
Microbiote commensal de la peau, des poumons et du lait maternel
Les modifications récentes de la flore cutanée, pulmonaire et du lait maternel ont été peu étudiées. Avant l’invention des savons et détergents, la peau était probablement colonisée par des bactéries de type AOB (ammonia-oxidizing bacteria). Elles sont omniprésentes dans le sol, mais sont très sensibles aux détergents (sulfonates alkylbenzènes) [21]. Ces bactéries peuvent transformer les fortes concentrations d’urée et d’ammoniac de notre sueur en nitrite et oxyde nitrique (NO). Ces molécules étant rapidement réabsorbées par la peau, cette source biologique de nitrite devait être significative [21], et capable de compléter les transformations nitrate/nitrite/NO au cours du cycle bien connu : sang – salive – estomac – sang. Feelisch pense que l’homme a une carence nitrique en raison du manque d’AOB dans la flore cutanée [21]. Comme l’oxyde nitrique est indispensable à la régulation immunitaire, cela pourrait être une autre voie de perturbation de notre système immunitaire par l’hygiène moderne. Cela mérite, en tout cas, de plus amples recherches.
Le poumon, lui non plus, ne peut être stérile, et certains commencent à étudier la flore des bronches et des voies aériennes supérieures.
Il a été récemment constaté que le lait maternel n’est pas stérile [31]. Il semble exister une circulation « entéro-mammaire ». Pendant la lactation, le transfert des bactéries de l’intestin aux plaques de Peyer est augmenté, et des signatures d’acides nucléiques bactériens sont décelées dans les mononucléaires sanguins. Des bactéries sont également présentes dans la glande mammaire saine et dans les mononucléaires du lait maternel qui, même « stérile », contient un petit nombre de micro-organismes cultivables. Ces mononucléaires semblent être en partie des cellules dendritiques semi-matures tolérogènes qui pourraient induire des réponses tolérogènes chez le nouveau-né [31]. Il reste à savoir s’il s’agit d’une part importante de la colonisation intestinale et de l’éducation immunitaire du nouveau-né ; mais si tel est le cas, cela a dû être fortement perturbé chez les hommes modernes.
Compatibilité de l’hypothèse hygiéniste avec l’idée d’une cause d’ordre infectieux des inflammations chroniques
Il existe déjà des preuves que certaines infections virales peuvent déclencher des troubles auto-immuns [32], et il est probable que certains de ces troubles sont en fait causés par des infections silencieuses [33]. Ces vérités ne sont pas incompatibles avec l’hypothèse hygiéniste. Les micro-organismes en question ne causaient manifestement pas de telles maladies dans le passé, puisque la plupart d’entre elles (allergies, MICI, sclérose en plaques, DT1) étaient rares. Le problème d’immunorégulation consécutif au manque de « vieux amis » peut faciliter les phénomènes d’auto-immunité et favoriser également des infections qui ne provoquaient pas de maladies avant la seconde transition épidémiologique.
Variants génétiques compensatoires
Dans les régions du monde où la pression des micro-organismes inducteurs d’immunité a été forte, il y a eu sélection de polymorphismes nucléotidiques (SNP : single nucleotide polymorphisms) ou d’autres variants pour compenser en partie l’immunorégulation. Cela a été constaté pour plusieurs cytokines proinflammatoires [34] et des IgE [35]. Une augmentation de fréquence de formes tronquées du transporteur correspond aussi à un effet pro-inflammatoire plus marqué [36]. Tout devient alors plus clair : dès que les micro-organismes inducteurs d’immunorégulation ont disparu avec le mode de vie moderne, ces variants génétiques ont induit une inflammation excessive et sont devenus des risques de désordres inflammatoires chroniques [34–36]. Ceci constitue un second niveau de dépendance à la présence continue de nos « vieux amis ».
Interactions avec d’autres changements de nos modes de vie modernes
Il serait stupide de penser que la baisse d’exposition à nos “vieux amis” est l’unique cause des inflammations chroniques dans les pays développés. D’autres aspects de la vie moderne doivent y contribuer, et probablement, amplifient et interagissent avec le déficit d’immunorégulation résultant des modifications de notre environnement microbien. L’alimentation excessive et l’obésité s’accompagnent de modifications de la flore intestinale, et augmentent la production de cytokines pro-inflammatoires [37]. Le stress psychologique modifie également la flore intestinale, ainsi que l’absorption digestive, en augmentant la production de corticolibérine (CRH : corticoptropin-releasing-hormone) qui, elle, augmente la perméabilité du mucus intestinal. L’augmentation de l’absorption de lipopolysaccharides (LPS) et d’autres composants microbiens conduit à une plus grande libération de cytokines proinflammatoires [38]. La vitamine D joue également un rôle au niveau des cellules T régulatrices [39]. Le déficit en vitamine D est très fréquent, et de plus en plus mentionné comme facteur d’augmentation des inflammations chroniques. La pollution, et particulièrement les dioxines, qui modifient les lymphocytes Th17 via le récepteur aryl-hydrocarbone [40], augmentent les réponses inflammatoires. Enfin, les modifications intestinales ont un impact sur le développement des Th17. Chez certains individus, des niveaux élevés de cytokines pro-inflammatoires conduisent à une dépression qui se répercute à son tour sur le cycle CRH/intestin. 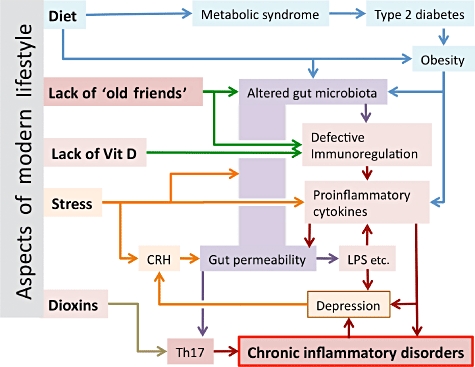 (figure 2)
(figure 2)
Les conséquences cliniques générales
L’éventualité que d’autres pathologies, en plus des allergies, maladies auto-immunes et MICI (IBD), soient considérées à la lumière de l’hypothèse hygiéniste, a été largement analysée par divers spécialistes de chaque discipline concernée [41] [42]. Citons l’athérosclérose, les dépressions accompagnées d’une augmentation des cytokines pro-inflammatoires circulantes, certains cancers et maladies neuro-dégénératives, et même le faux diabète ou diabète de type 2. Comme la plupart de ces sujets restent encore débattus et spéculatifs, nous n’en ferons ici qu’un bref survol. 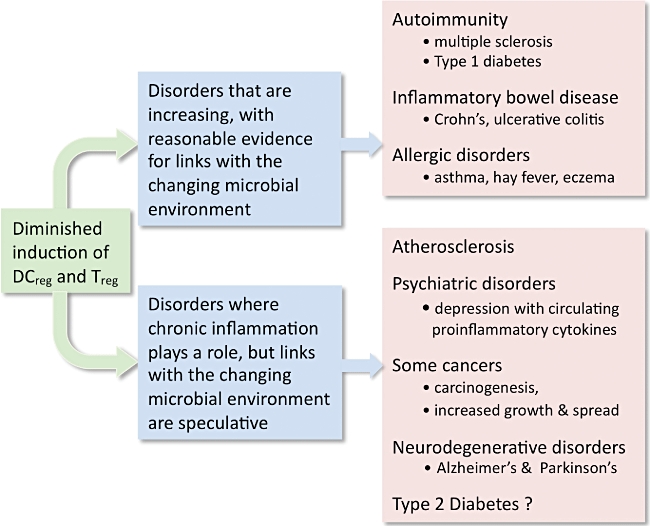 (figure 3)
(figure 3)
Cancer
Le fait qu’un retard d’infection par certains micro-organismes puisse expliquer l’augmentation récente des LLA de l’enfant, a déjà été mentionné [19].
Il est une autre voie d’explication de certains cancers par l’hypothèse hygiéniste. L’impossibilité de mettre fin à une inflammation inappropriée peut favoriser l’oncogenèse. L’inflammation chronique est corrélée à un risque accru de cancer [43]. Les médiateurs de l’inflammation sont impliqués dans le contrôle de la duplication cellulaire, l’angiogenèse et la migration cellulaire, et, les radicaux libres (ROI : reactive oxygen intermediates) peuvent endommager l’ADN. Beaucoup de processus inflammatoires sont régulés par le NF-κB (transcription nuclear factor kappaB), et la manipulation de ce NF-κB a de profonds effets sur la carcinogenèse. Curieusement, pour le TNFα (tumour necrosis factor α), les souris pourvues du TNF récepteur 1 (TNFR1) sont plus résistantes à la carcinogenèse induite chimiquement. De la même façon, plusieurs polymorphismes nucléotidiques de chimiokines et de cytokines sont associés à la malignité [43]. Un apport régulier d’anti-inflammatoires non stéroïdiens comme l’aspirine, diminue le risque de cancer colorectal [44].
Dépression
L’incidence de la dépression augmente. De récentes études ont permis de ne pas changer les critères diagnostiques, tout en mieux contrôlant l’abus de psychotropes [45]. Beaucoup de personnes souffrant de dépression ont des niveaux élevés de marqueurs de l’inflammation, y compris de cytokines pro-inflammatoires, et de bas niveaux de médiateurs anti-inflammatoires en l’absence de toute inflammation connue [38]. De même, lorsqu’il existe une maladie inflammatoire identifiée, la dépression est davantage corrélée au taux de cytokines qu’aux symptômes de la maladie elle-même. La prescription de cytokines inflammatoires pour l’immunothérapie de certains cancers ou de l’hépatite [IFN-α or interleukine (IL)-2], favorise la dépression, alors que les antidépresseurs provoquent une augmentation relative de cytokines anti-inflammatoires [38]. Certains moyens par lesquels le microbiome peut influencer le système nerveux central, sont abordés dans un article cité en référence [46]. Ainsi, la perte récente des voies de régulation pour stopper l’inflammation peut fournir d’autres mécanismes [38] et contribuer à la récente augmentation de la dépression [45].
Athérosclérose
L’athérosclérose est une lésion inflammatoire médiée par les Th1. Dans les modèles animaux, elle est excessivement sensible à l’inhibition par les interleukines 10 (IL-10) ou les cellules T régulatrices (Tregs), et les preuves s’accumulent de la même action bénéfique des IL10 chez l’homme [47]. L’athérosclérose est plus fréquente en cas d’élévation chronique de la C-réactive protéine (CRP) et, comme pour la dépression, elle est plus fréquente en présence d’autres désordres inflammatoires chroniques [48].
Maladies neurodégénératives
Les maladies neurodégénératives, Alzheimer et Parkinson, semblent liées à l’inflammation. Il existe quelques preuves que les SNP de gènes codant les cytokines pro et anti-inflammatoires influencent la susceptibilité à ces maladies. Une importante méta-analyse conclut que la prise prolongée d’AINS peut apporter une certaine protection contre la maladie d’Alzheimer [49]). Le TGF-β (transforming growth factor β) pourrait avoir quelque effet contre l’Alzheimer, autant par ses propriétés immunomodulatrices et anti-inflammatoires que par son action sur l’élimination des amyloïdes-β [49].
Diabète de type 2
Le diabète de type 1 est une maladie auto-immune, alors que le diabète de type 2 est un simple trouble métabolique. De nouveaux éléments jettent un doute sur cette distinction. L’inflammation peut être détectée sur des îlots endommagés du DT2 [50]. Ceci pourrait être dû au stress métabolique associé à la mauvaise alimentation et à l’obésité, mais pourrait également impliquer un déficit immunitaire. Comme expliqué ci-dessus, le stress métabolique pourrait augmenter et interagir avec les effets d’une exposition réduite aux micro-organismes inducteurs d’immunorégulation.
Le futur
L’identification progressive d’organismes confirmant l’hypothèse hygiéniste, conduit déjà à de passionnants essais cliniques sur de nouvelles thérapeutiques des MICI, allergies et sclérose en plaques. De même, certains essais de bactéries inductrices de Treg sont en cours pour les dépressions qui s’accompagnent de niveaux élevés de cytokines. On a déterminé la charge maximale d’ankylostomes qui peut être supportée sans effets indésirables [51]. Un essai de phase 1 a été réalisé dans la rhinite allergique [52], et plusieurs études sont en cours dans l’allergie, la sclérose en plaques et les MICI. Le trichure du porc a été testé dans les MICI [53], et il est désormais essayé dans d’autres pathologies. Entre-temps, les partisans des probiotiques se rendent compte que les souches utilisées dans les essais sur l’inflammation chronique doivent être sélectionnées sur leur capacité à induire de l’immunorégulation. Ces essais n’ont aucune signification lorsqu’ils utilisent des souches inadéquates imposées par des compagnies qui en détiennent les brevets.
Cependant, il demeure quelques questions cruciales, encore difficiles à aborder, et qui gênent notre prédiction à long terme. Il est difficile de prévoir entre une inadéquation grandissante entre nos gènes et notre environnement, ou l’apparition de solutions simples à ce problème :
- Les modifications dues à ces pertes microbiennes sont-elles achevées, ou verra-t-on d’autres espèces amies éliminées par les antibiotiques ou par de nouveaux comportements ? Par exemple, qu’adviendrait-il si nous éliminions Pneumocystis ?
- Combien de fonctions ou mécanismes, capables de mettre en place de nouveaux équilibres au sein du système immunitaire, doivent être déclenchés par les micro-organismes ou leurs composants ? Les effets marquants du polysaccharide de Bacteroides Fragilis administrés aux souris stériles [20] laissent penser que peu de molécules réellement utiles sont impliquées, mais ce n’est qu’une spéculation.
- Y a-t-il des redondances ou des recoupements significatifs dans les rôles de nos « vieux amis » ? Les résultats incohérents des études épidémiologiques réalisées en différentes régions du monde, laissent penser que oui. L’importance d’un organisme particulier dépend de sa présence ou non dans un environnement donné. Du point de vue évolutionniste, la redondance est probable.
- Est-ce que certains effets des micro-organismes traversent les générations ? Si oui, est-ce par :
- médiateurs et anticorps transmis lors de la grossesse ou de l’allaitement ?
- microbiome maternel transmis à l’enfant ?
- modifications épigénétiques ?
Conclusions
Dans ce document j’ai considéré fondamentalement exacte, la vision actuelle de l’hypothèse hygiéniste comme un problème d’immuno-régulation, et dont les mécanismes sont détaillés dans d’autres articles [30,32,54]. J’ai essayé d’en explorer les principes sous-jacents à un niveau environnemental et évolutionniste. Les points de vue exprimés ici, aident à expliquer l’échec constant de l’étude épidémiologique des infections pédiatriques cliniquement apparentes et identifiées. De telles études ne mettent jamais en évidence la protection contre les allergies [55]. Les biais de ces études résultent d’une interprétation hâtive des constatations originales de Strachan et ses collaborateurs [56] qui n’étaient pas passées au crible Darwinien. Maintenant, nous devons nous concentrer sur les organismes qui ont un long passé associatif avec le système immunitaire des mammifères, aisément traçable jusqu’au paléolithique ou avant. Souvent, ces organismes ont été des commensaux ou « pseudo-commensaux » d’infections infra-cliniques ou de portage sain. Ce type de raisonnement est une source de progrès pour l’épidémiologie future ; il peut aider à trouver des solutions au problème croissant des désordres inflammatoires, et élargir la gamme des micro-organismes utilisés dans les essais cliniques.
Bibliographie
Rook G.A.W.
Hygiene hypothesis
ClinExp Immunol. 2010 April; 160(1): 70–79.
DOI : 10.1111/j.1365-2249.2010.04133.x
1. de Mazancourt C, Loreau M, Dieckmann U. Understanding mutualism when there is adaptation to the partner. J Ecol. 2005;93:305–14.
2. Jeon KW. Development of cellular dependence on infective organisms: micrurgical studies in amoebas. Science. 1972;176:1122–3. [PubMed]
3. Bowlby J. Attachment and loss, volume 1: attachment. Harmondsworth, Middlesex: Penguin; 1971. first published by Hogarth Press in 1969.
4. Hawks J, Wang ET, Cochran GM, et al. Recent acceleration of human adaptive evolution. Proc Natl Acad Sci USA. 2007;104:20753–8. [PMC free article] [PubMed]
5. Armelagos GJ, Harper KN. Genomics at the origins of agriculture, part two; evolutionary anthropology. Evol Anthropol. 2005;14:109–21.
6. Hoberg EP. Phylogeny of Taenia: species definitions and origins of human parasites. Parasitol Int. 2006;55(Suppl.):S23–30. [PubMed]
7. Caldwell JC. Population health in transition. Bull World Health Organ. 2001;79:159–60. [PMC free article] [PubMed]
8. Armelagos GJ, Brown PJ, Turner B. Evolutionary, historical and political economic perspectives on health and disease. Soc Sci Med. 2005;61:755–65. [PubMed]
9. Van Blerkom LM. Role of viruses in human evolution. Yearb Phys Anthropol. 2003;46:14–46. [PubMed]
10. Harrison T, Dusheiko GM, Zuckerman AJ. Hepatitis viruses. In: Zuckerman AJ, Banatvala JE, Schoub BD, Griffiths PD, Mortimer P, editors. Principles and practice of clinical virology. Chichester: John Wiley & Sons, Ltd; 2009. pp. 269–316.
11. Kidgell C, Reichard U, Wain J, et al. Salmonella typhi, the causative agent of typhoid fever, is approximately 50 000 years old. Infect Genet Evol. 2002;2:39–45. [PubMed]
12. Aliouat-Denis CM, Chabe M, Demanche C, et al. Pneumocystis species, co-evolution and pathogenic power. Infect Genet Evol. 2008;8:708–26. [PubMed]
13. Gagneux S, Small PM. Global phylogeography of Mycobacterium tuberculosis and implications for tuberculosis product development. Lancet Infect Dis. 2007;7:328–37. [PubMed]
14. Mira A, Pushker R, Rodriguez-Valera F. The Neolithic revolution of bacterial genomes. Trends Microbiol. 2006;14:200–6. [PubMed]
15. Umetsu DT, DeKruyff RH. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Microbes, apoptosis and TIM-1 in the development of asthma. Clin Exp Immunol. 2010;160:125–9. [PMC free article] [PubMed]
16. Schroder NW. The role of innate immunity in the pathogenesis of asthma. Curr Opin Allergy Clin Immunol. 2009;9:38–43. [PubMed]
17. Harrison LC, Honeyman MC, Morahan G, et al. Type 1 diabetes: lessons for other autoimmune diseases? J Autoimmun. 2008;31:306–10. [PubMed]
18. von Herrath M. Can we learn from viruses how to prevent type 1 diabetes?: the role of viral infections in the pathogenesis of type 1 diabetes and the development of novel combination therapies. Diabetes. 2009;58:2–11. [PMC free article] [PubMed]
19. Greaves M. Infection, immune responses and the aetiology of childhood leukaemia. Nat Rev Cancer. 2006;6:193–203. [PubMed]
20. Mazmanian SK, Round JL, Kasper DL. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 2008;453:620–5. [PubMed]
21. Whitlock DR, Feelisch M. Soil bacteria, nitrite, and the skin. In: Rook GAW, editor. The hygiene hypothesis and Darwinian medicine. Basel: Birkhäuser; 2009. pp. 103–16.
22. Pelosi U, Porcedda G, Tiddia F, et al. The inverse association of salmonellosis in infancy with allergic rhinoconjunctivitis and asthma at school-age: a longitudinal study. Allergy. 2005;60:626–30. [PubMed]
23. Matricardi PM, Rosmini F, Riondino S, et al. Exposure to foodborne and orofecal microbes versus airborne viruses in relation to atopy and allergic asthma; epidemiological study. BMJ. 2000;320:412–7. [PMC free article] [PubMed]
24. Umetsu DT, McIntire JJ, DeKruyff RH. TIM-1, hepatitis A virus and the hygiene theory of atopy: association of TIM-1 with atopy. J Pediatr Gastroenterol Nutr. 2005;40(Suppl. 1):S43. [PubMed]
25. Seiskari T, Kondrashova A, Viskari H, et al. Allergic sensitization and microbial load – a comparison between Finland and Russian Karelia. Clin Exp Immunol. 2007;148:47–52. [PMC free article] [PubMed]
26. Linz B, Balloux F, Moodley Y, et al. An African origin for the intimate association between humans and Helicobacter pylori. Nature. 2007;445:915–8. [PMC free article] [PubMed]
27. Sibley LD, Ajioka JW. Population structure of Toxoplasma gondii: clonal expansion driven by infrequent recombination and selective sweeps. Annu Rev Microbiol. 2008;62:329–51. [PubMed]
28. Mazmanian SK, Kasper DL. The love–hate relationship between bacterial polysaccharides and the host immune system. Nat Rev Immunol. 2006;6:849–58. [PubMed]
29. Wen L, Ley RE, Volchkov PY, et al. Innate immunity and intestinal microbiota in the development of Type 1 diabetes. Nature. 2008;455:1109–13. [PMC free article] [PubMed]
30. Belkaid Y, Liesenfeld O, Maizels RM. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Induction and control of regulatory T cells in the gastrointestinal tract: consequences for local and peripheral immune responses. Clin Exp Immunol. 2010;160:35–41. [PMC free article] [PubMed]
31. Perez PF, Dore J, Leclerc M, et al. Bacterial imprinting of the neonatal immune system: lessons from maternal cells? Pediatrics. 2007;119:e724–32. [PubMed]
32. Getts MT, Miller SD. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Triggering of autoimmune diseases by infections. Clin Exp Immunol. 2010;160:15–21. [PMC free article] [PubMed]
33. Ewald PW. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Symbionts and immunopathology in chronic diseases: insights from evolution. Clin Exp Immunol. 2010;160:27–34. [PMC free article] [PubMed]
34. Fumagalli M, Pozzoli U, Cagliani R, et al. Parasites represent a major selective force for interleukin genes and shape the genetic predisposition to autoimmune conditions. J Exp Med. 2009;206:1395–408. [PMC free article] [PubMed]
35. Barnes KC, Grant AV, Gao P. A review of the genetic epidemiology of resistance to parasitic disease and atopic asthma: common variants for common phenotypes? Curr Opin Allergy Clin Immunol. 2005;5:379–85. [PubMed]
36. Fredericks CA, Drabant EM, Edge MD, et al. Healthy young women with serotonin transporter SS polymorphism show a pro-inflammatory bias under resting and stress conditions. Brain Behav Immun. 2009 doi 10.1016/j.bbi.2009.10.014 [Epub ahead of print] [PMC free article] [PubMed]
37. Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins. Nature. 2009;457:480–4. [PMC free article] [PubMed]
38. Rook GAW, Lowry CA. The hygiene hypothesis and psychiatric disorders. Trends Immunol. 2008;29:150–8. [PubMed]
39. Xystrakis E, Kusumakar S, Boswell S, et al. Reversing the defective induction of IL-10-secreting regulatory T cells in glucocorticoid-resistant asthma patients. J Clin Invest. 2006;116:146–55. [PMC free article] [PubMed]
40. Veldhoen M, Hirota K, Westendorf AM, et al. The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins. Nature. 2008;453:106–9. [PubMed]
41. Rook GAW. The broader implications of the hygiene hypothesis. Immunology. 2009;126:3–11. [PMC free article] [PubMed]
42. Rook GAW. The hygiene hypothesis and Darwinian medicine. In: Parnham M, editor. Progress in inflammation research. Basel: Birkhäuser; 2009. p. 317.
43. Aggarwal BB, Shishodia S, Sandur SK, et al. Inflammation and cancer: how hot is the link? Biochem Pharmacol. 2006;72:1605–21. [PubMed]
44. Flossmann E, Rothwell PM. Effect of aspirin on long-term risk of colorectal cancer: consistent evidence from randomised and observational studies. Lancet. 2007;369:1603–13. [PubMed]
45. Compton WM, Conway KP, Stinson FS, et al. Changes in the prevalence of major depression and comorbid substance use disorders in the United States between 1991–1992 and 2001–2002. Am J Psychiatry. 2006;163:2141–7. [PubMed]
46. Bienenstock J, Collins SM. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Psycho-neuroimmunology and the intestinal microbiota: clinical observations and basic mechanisms. Clin Exp Immunol. 2010;160:85–91. [PMC free article] [PubMed]
47. Kuiper J, van Puijvelde GH, van Wanrooij EJ, et al. Immunomodulation of the inflammatory response in atherosclerosis. Curr Opin Lipidol. 2007;18:521–6. [PubMed]
48. Ait-Oufella H, Tedgui A, Mallat Z. Immune regulation in atherosclerosis and the hygiene hypothesis. In: Rook GAW, editor. Darwinian medicine and the hygiene hypothesis. Basel: Birkhäuser; 2009. pp. 221–38.
49. Wyss-Coray T. Inflammation in Alzheimer disease: driving force, bystander or beneficial response? Nat Med. 2006;12:1005–15. [PubMed]
50. Ehses JA, Boni-Schnetzler M, Faulenbach M, et al. Macrophages, cytokines and beta-cell death in Type 2 diabetes. Biochem Soc Trans. 2008;36:340–2. [PubMed]
51. Mortimer K, Brown A, Feary J, et al. Dose-ranging study for trials of therapeutic infection with Necator americanus in humans. Am J Trop Med Hyg. 2006;75:914–20. [PubMed]
52. Blount D, Hooi D, Feary J, et al. Immunological profiles of subjects recruited for a randomized, placebo controlled clinical trial of hookworm infection. Am J Trop Med Hyg. 2009;81:911–6. [PubMed]
53. Summers RW, Elliott DE, Urban JF, Jr, et al. Trichuris suis therapy in Crohn's disease. Gut. 2005;54:87–90. [PMC free article] [PubMed]
54. Okada H, Kuhn CH, Feillet H, Bach J-F. The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010;160:1–9. [PMC free article] [PubMed]
55. Bremner SA, Carey IM, DeWilde S, et al. Infections presenting for clinical care in early life and later risk of hay fever in two UK birth cohorts. Allergy. 2008;63:274–83. [PubMed]
56. Strachan DP. Hay fever, hygiene, and household size. BMJ. 1989;299:1259–60. [PMC free article] [PubMed]
Autres références
Related citations in PubMed
- Hygiene and other early childhood influences on the subsequent function of the immune system. [Dig Dis. 2011]
- 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: lifestyle changes affecting the host-environment interface. [Clin Exp Immunol. 2010]
- Review series on helminths, immune modulation and the hygiene hypothesis: the broader implications of the hygiene hypothesis. [Immunology. 2009]
- 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: symbionts and immunopathology in chronic diseases: insights from evolution. [Clin Exp Immunol. 2010]
- 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: the role of infections in allergy: atopic asthma as a paradigm. [Clin Exp Immunol. 2010]
Cited by other articles in PMC
- Reduced Bacterial Biodiversity Is Associated with Increased Allergy [Environmental Health Perspectives. 2012]
- Environmental biodiversity, human microbiota, and allergy are interrelated [Proceedings of the National Academy of Scie...]
- Systems solutions by lactic acid bacteria: from paradigms to practice [Microbial Cell Factories. ]
- Cesarean versus Vaginal Delivery: Long term infant outcomes and the Hygiene Hypothesis [Clinics in perinatology. 2011]
- DC Priming by M. vaccae Inhibits Th2 Responses in Contrast to Specific TLR2 Priming and Is Associated with Selective Activation of the CREB Pathway [PLoS ONE. ]
Links
- PubMed
- Taxonomy
- Taxonomy Tree
- 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disor...
- Development of cellular dependence on infective organisms: micrurgical studies in amoebas. [Science. 1972]
- Recent acceleration of human adaptive evolution. [Proc Natl Acad Sci U S A. 2007]
- Review Phylogeny of Taenia: Species definitions and origins of human parasites. [Parasitol Int. 2006]
- Population health in transition. [Bull World Health Organ. 2001]
- Evolutionary, historical and political economic perspectives on health and disease. [Soc Sci Med. 2005]
- Review Phylogeny of Taenia: Species definitions and origins of human parasites. [Parasitol Int. 2006]
- Salmonella typhi, the causative agent of typhoid fever, is approximately 50,000 years old. [Infect Genet Evol. 2002]
- Review Global phylogeography of Mycobacterium tuberculosis and implications for tuberculosis product development. [Lancet Infect Dis. 2007]
- Population health in transition. [Bull World Health Organ. 2001]
- Evolutionary, historical and political economic perspectives on health and disease. [Soc Sci Med. 2005]

Et pour aller plus loin
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
RARE
Site médical sans publicité
et sans conflit d'intérêts.
La phrase biomédicale aléatoire
La biomédecine a déplacé l’obsession diagnostique de plus en plus en amont dans le cours de la vie, chez des personnes ne présentant aucun symptôme. [...] L’obsession diagnostique et la technologie ont progressivement conduit la biomédecine à estimer que les signes paracliniques ont un potentiel de morbidité supérieur à celui des symptômes. Il devient ainsi licite de traquer ces signes paracliniques, le plus tôt possible, sans attendre des symptômes qui deviennent alors la preuve d’un retard diagnostique.
― Luc Perino
