Evolution du système immunitaire
dernière mise à jour le 12/02/2021
1/ Introduction
Cet article examine le développement de la réponse immunitaire depuis le fœtus jusqu’au déclin de la sénescence. Le nouveau-né arrive avec un système immunitaire inné et adaptatif immature, il murit et acquiert de la mémoire tout au long de la vie, puis décline avec la vieillesse. Ces modifications sont examinées en lien avec les risques de différents types d'infection, maladies auto-immune et tumeurs malignes.
Plus de 1600 gènes sont impliqués dans les réponses immunitaires innées et adaptatives. Ces gènes sont d'une grande importance pour le maintien de la vie dans un environnement hostile. Pourtant, le système immunitaire est relativement immature à la naissance et doit évoluer au cours de la vie.
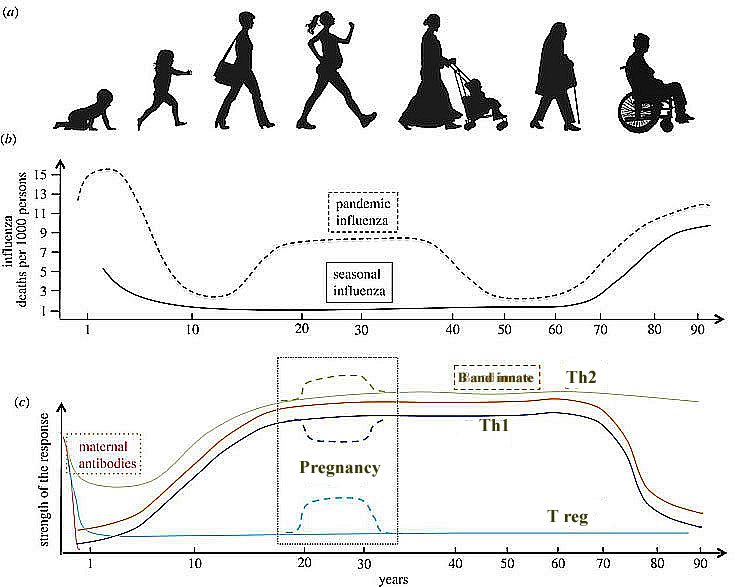
Figure 1 : (a) Les 7 âges de la femme. (b) Schema des morts en excès par grippe saisonnière ou pandémique tout au long de la vie d'un individu (nombre de morts pour 1000 personnes). Notez que le risque de grippe sévère augmente pendant la grossesse. (c) Schema des différents moyens immunitaires contre la grippe au cours d'une vie individuelle.
2/ Ontogenèse du système immunitaire en début de vie
In utero, le système immunitaire doit rester tolérant aux alloantigènes maternels. A la naissance, l'énorme exposition soudaine aux antigènes environnementaux, dont beaucoup sont des bactéries commensales intestinales, oblige à un rapide changement des réponses immunitaires.
a) Le système immunitaire inné
Le système immunitaire inné fournit une première ligne de défense contre les pathogènes. Les opérateurs sont les neutrophiles, les monocytes, les macrophages et les cellules dendritiques, qui toutes interagissent avec le système immunitaire adaptatif. Ces cellules se développent et mûrissent pendant la vie fœtale, mais à des moments différents, et l’immunité innée des nouveau-nés est encore faible.
Des neutrophiles matures sont présents à la fin du premier trimestre et leur nombre augmente fortement, peu de temps avant la naissance, sous l’effet des facteurs de croissance de stimulation de colonies de granulocytes. Leur nombre revient alors à un niveau stable en quelques jours, mais ils ont de faibles fonctions bactéricides, répondent peu aux stimuli inflammatoires, ont une adhésivité réduite aux cellules endothéliales et un chimiotactisme diminué. Ces déficits sont encore plus frappants chez les prématurés, qui ont également de faibles taux sériques d’IgG et de complément. Par conséquent, les nouveau-nés, et en particulier les prématurés, ont une déficience des fonctions des neutrophiles, les exposant au risque d'infections bactériennes.
Chez les prématurés et nouveau-nés, les monocytes et les macrophages classiques sont aussi immatures. Ils ont une expression réduite de TLR4 avec une insuffisance des voies innées de signalisation, donc de faibles réponses des cytokines par rapport aux adultes. Par conséquent, il y a peu de réparation tissulaire, peu de phagocytose des agents pathogènes potentiels et une faible sécrétion de molécules bioactives. Cependant, les niveaux adultes de macrophages pulmonaires sont atteints en quelques jours après la naissance.
Le sang du cordon contient moins de cellules dendritiques de type myéloïde (Mdc). Leur surface exprime moins de HLA de classe II, de CD80 et de CD86 que les adultes. Elles sécrètent de plus faibles concentrations d'IL-12p70 en réponse aux stimuli. Ainsi l'amorçage des réponses Th1 et CD8 des lymphocytes T est diminuée par rapport aux adultes, conduisant à une susceptibilité accrue aux virus, BK et Salmonella. En revanche, la stimulation via TLR4 conduit à des concentrations de cytokines pro-inflammatoires pour des réponses immunitaires Th17 semblables aux adultes.
Chez l’adulte, les cellules dendritiques plasmacytoïdes (pDC) libèrent des concentrations élevées d'interféron de type I (IFN) en réponse aux stimulations TLR7 et TLR9. Cependant, les pDC des nouveau-nés sont sévèrement limitées dans les sécrétions d'interféron α / β lors d'expositions à différents virus, en dépit de niveaux d’expression de TLR7 et TLR9 semblables aux adultes. Par conséquent, les réponses immunitaires innées à des virus tels que le virus respiratoire syncytial, le virus de l'herpès simplex et le cytomégalovirus sont faibles en comparaison à celles observées plus tard dans la vie.
Les Natural Killer (NK) chez les adultes limitent la réplication et la diffusion virales avant l’intervention de l'immunité adaptative. Ils sont régulés par l’inhibition des récepteurs qui reconnaissent HLA-A, B, C et E, et par conséquent contribuent à l’auto-tolérance. Au début de la gestation, les cellules NK sont peu sensibles aux cellules cibles dépourvues de molécules de la classe I du CMH (tels que le trophoblaste) et sont très sensibles à l'immunosuppression, en transformant le facteur de croissance β (TGF-β). La fonction cytolytique des NK augmente pendant la gestation, mais, à la naissance, elle n’est encore qu’à la moitié du niveau adulte. Les cellules NK néonatales sont moins sensibles à l'activation par l'IL-2 et IL-15, et produisent des concentrations limitées d'IFN-γ. Cependant, le seuil d’activation cellulaire est plus faible, ce qui assure une certaine protection antivirale.
Les trois voies indépendantes qui activent le système du complément sont essentielles pour l’inflammation et la défense de l'hôte. Les composants du complément facilitent l’opsonisation, sont chimio-attractifs pour les cellules innées, ils régulent la lyse cellulaire et influencent la production d'anticorps. Les concentrations sériques du nouveau-né pour la quasi-totalité de ces composants sont de 10 à 80% plus faibles que chez les adultes, avec une activité biologique réduite. Leurs niveaux augmentent après la naissance, avec certains la concentration des adultes en un mois (par exemple le facteur B), mais d'autres évoluent plus lentement. Comme les enfants ont de faibles concentrations d'immunoglobulines, les fonctions effectrices du complément dépendront d’autres voies dont les liaisons lectine, déclenchées par les polysaccharides et les endotoxines.
Dans l'ensemble, le système immunitaire inné est silencieux à la naissance, C’est le prix à payer pour tolérer les antigènes maternels, mais aussi pour éviter d’avoir à gérer l’énorme stress du remodelage lié au développement fœtal. Cela rend le nouveau-né, et en particulier le prématuré, relativement sensibles aux infections bactériennes et virales.
b) Le système immunitaire adaptatif
Les cellules T se développent dans le thymus, qui est le plus gros à la naissance et pendant les premières années de vie. Les cellules T matures simples CD4 + et CD8 + sont d'abord détectés dans le thymus à la semaine 15 et abondent à sa périphérie bien avant la naissance. Cependant, les cellules T néonatales diffèrent sensiblement des cellules adultes, ce qui reflète la vie fœtale où l'exposition à des antigènes étrangers est limitée aux alloantigènes maternels non hérités. La fonction de ces cellules T est aussi différente de celle des cellules d’adultes. Par exemple, bien que les cellules T naïves fœtales CD4+ répondent fortement aux alloantigènes, elles ont tendance à évoluer en cellules T régulatrices Foxp3+ CD25+ sous l'influence du TGF-β, et donc à promouvoir activement l'auto-tolérance. Les T régulatrices périphérique représentent environ 3% du nombre total de cellules T CD4+ à la naissance, et ces cellules persistent pendant assez longtemps, ce qui confère un profil inflammatoire à la réponse immunitaire en début de vie.
L’activation aux antigènes étrangers des cellules T de fin de grossesse et de la période néonatale conduit à une réponse biaisée en faveur de la voie Th2, renforcée par les cellules dendritiques néonatales et des caractéristiques épigénétiques. Ainsi, l'immunité adaptative des cellules T néo-natales est caractérisée par ses réponses tolérogènes, une reconnaissance réduite des allo-antigènes et de faibles réponses à des antigènes étrangers.
Chez le nouveau-né, en plus des cellules T conventionnelles qui reconnaissent les antigènes peptidiques dans le cadre classique des molécules du CMH, il existe des populations de récepteurs de lymphocytes T γδ (TCR) des cellules T innées like-aß TCR-positives. Celles-ci comprennent des cellules iNKT fonctionnellement compétentes qui produisent rapidement IFN, des invariantes associées aux muqueuses (MAIT) et les nouvellement décrites cellules T naïves sécrétrices d'interleukine-8 (CXCL8) qui font le pont entre l’immunité innée et l'immunité adaptative. Les cellules MAIT se développent dans le thymus, mais leur maturation peut avoir lieu dans les muqueuses fœtales avant la colonisation microbienne. Les CXCL8 ont d’importantes fonctions chez le nouveau-né et peuvent activer les neutrophiles antimicrobiennes et les cellules Tγδ. Elles sont particulièrement actives au niveau des barrières muqueuses des prématurés et nouveau-nés à terme, bien que leur fréquence diminue avec l'âge gestationnel. Par contraste avec le sang adulte, où les TCR γδ ont un répertoire limité, celles du nouveau-né présentent une grande variété de combinaisons de chaînes de récepteur qui évoluent en cours de gestation. Les cellules Tγδ peuvent produire des quantités importantes d'IFN-γ, après de brèves stimulations polyclonales, compensant l'immaturité de la réponse classique des cellules T de type Th1 en cas d’infection néonatale.
Deux types de cellules B découlent de voies distinctes de développement. Les cellules B1 sécrètent spontanément des IgM de faible affinité ayant une gamme limitée de spécificités antigéniques (dont les polysaccharides bactériens courants), elles ont moins de mutations somatiques et servent comme première ligne de défense. Les cellules B1 sécrètent de l'IL-10 et du TGF-β, et favorisent ainsi une réponse Th2. A la naissance, les cellules B1 représentent 40% des cellules B du sang périphérique et cette fréquence reste élevée pendant quelques mois. Les cellules B conventionnelles (nommées B2), provenant d’une large lignée de CD34, génèrent un vaste répertoire d’immunoglobulines spécifiques lié à l’expression de leur désoxynucléotidyl transferase terminale, ce qui augmente la diversité des recombinaisons V-D-J. Les cellules B sont typiquement présentes dans les organes lymphoïdes secondaires et dans la moelle osseuse, où elles contribuent à la réponse humorale du système immunitaire adaptatif.
La plupart des réponses d'anticorps (protéines bactériennes, polysaccharides bactériens et vaccins conjugués polysaccharide-protéine) sont dépendantes des lymphocytes T helper (Th). Ils reposent sur des interactions entre le TCR et l'engagement des corécepteurs (CD28, CD40) sur les cellules Th2 ou Th folliculaires avec leurs partenaires de liaison HLA correspondants (CD80 / 86 et CD40) sur les cellules B spécifiques d'antigène. Cependant, les cellules B néonatales expriment de faibles niveaux de ces corécepteurs, ce qui limite leur capacité à répondre. En outre, le faible niveau du récepteur du fragment C3d du complément (CD21) empêche les réponses aux complexes polysaccharide-complément. Cet ensemble de caractéristiques contribue à émousser la réponse immunitaire humorale et à des classes d'immunoglobuline incomplètes, bien que des cellules B mémoires soient générées. Les cellules B de nouveau-nés et de nourrissons de moins de 2 mois montrent moins d’hypermutation somatique que chez les adultes, ce qui limite la maturation et l'affinité des anticorps. Enfin, les cellules stromales de la moelle osseuse peinent à soutenir à la fois la survie des plasmablastes à long terme et la différenciation en cellules plasmatiques, de sorte qu’après une première immunisation, les anticorps IgG décroissent rapidement, à la différence de ce qui se passe chez les plus grands enfants et les adultes. Par conséquent, l'efficacité du système immunitaire adaptatif est faible chez les nouveaux nés. Cet aspect physiologique rend très pertinent les programmes de vaccination. L’immunité innée altérée, les faibles réponses Th1 et le manque d’anticorps expliquent amplement pourquoi la mortalité néonatale peut être élevée dans des conditions de forte exposition à des agents pathogènes.
3/ De l’enfance à l’âge adulte
Le jeune enfant, alors même que ses systèmes immunitaires innés et adaptatifs commencent à mûrir, est vulnérable à de nombreux virus, bactéries, champignons et parasites pathogènes. Néanmoins, sa chance de survie dans les pays développés est bonne. Avant les progrès de l’amélioration, de l’hygiène alimentaire et des vaccinations, la mortalité des nourrissons et jeunes enfants était élevée. En 1900, le taux de mortalité infantile au Royaume-Uni était de 140 pour 1000, et il est tombé à 7 pour 1000 en 2000. Diminution de la mortalité qui a été bien plus forte que dans les autres groupes d'âge. La prévention et le contrôle des infections expliquent la majeure partie de cette baisse. Cependant, dans de nombreux pays, le taux de mortalité infantile reste supérieur à 50 pour 1000, ce qui donne une indication de la pression évolutive qui aboutit à un système immunitaire protecteur fonctionnel. En outre, cette pression conduit à un polymorphisme génétique extrême dans le CMH, qui, par la présentation des peptides aux cellules T et aux cellules NK, est un régulateur clé de presque toutes les réponses immunitaires.
Le système immunitaire mûrit progressivement pendant la petite enfance. Une protection précoce contre de nombreuses maladies infectieuses précédemment vécues par la mère est conférée aux enfants par un transfert passif d'anticorps IgG par le placenta puis le lait maternel. Après disparition de ces anticorps, les jeunes enfants deviennent plus vulnérables aux infections, mais ils se protègent progressivement par la maturation des systèmes immunitaires innés et adaptatifs. Les risques sont maintenant très réduits grâce aux vaccinations qui stimulent les réponses immunitaires protectrices dans le système immunitaire en cours de maturation. Néanmoins, les enfants peuvent encore être infectés par des virus, bactéries et parasites qui doivent être combattus et contrôlés par des réponses immunitaires. Au-delà de son pouvoir de guérison, une telle stimulation antigénique suscite la mémoire immunologique. Ainsi, au fil du temps, la protection fournie par la réponse immunitaire augmente, et les jeunes adultes ont moins d'infections. Cette accumulation de mémoire immunologique est une caractéristique évolutionniste de la réponse immunitaire adaptative. La mémoire persiste dans la vieillesse, mais peut aussi disparaître.
Outre les vraies infections et les vaccinations, le nouveau-né est exposé à d'autres antigènes. Il vient d'un environnement relativement stérile in utero et il est rapidement exposé à de multiples microbes. La première exposition importante aux bactéries se produit dans le défilé pelvien de la mère, puis se poursuit par les contacts, oral, cutané et respiratoire avec l'extérieur. Dès lors, l'exposition aux micro-organismes est continue. Beaucoup de bactéries qui colonisent l'intestin et d'autres muqueuses sont essentielles pour la santé, pour la digestion et pour l'acquisition de nutriments essentiels. Elles ont également un impact sur le développement du système immunitaire.
Environ 20% de tous les lymphocytes résident dans l'intestin, exposés à de très nombreux antigènes étrangers. Les cellules immunitaires intestinales surveillent un éventuel dépassement de limite pouvant conduire à une infection grave. Les bactéries intestinales influencent le développement de cellules Th17, de cellules T-reg et de cellules T mémoire. À la naissance, presque toutes les cellules T portent la glycoprotéine CD45RA, typique des cellules T naïves, qui n'ont jamais rencontré d'antigène étranger. Il existe également des T-reg relativement abondants dans les lymphocytes T CD4 à CD45RA négatif. Au cours de l'enfance, le nombre de cellules T-reg diminue, et les cellules Th1, Th17 et Th2 mémoire augmentent progressivement pour atteindre un nombre identique à celui des cellules T naïves. Bien que certaines de ces cellules T mémoire aient pu être stimulées par des infections à pathogènes spécifiques et par des vaccinations, beaucoup le sont par les microbiotes intestinaux, respiratoires et cutanés. Ces lymphocytes T mémoire ainsi amorcés peuvent réagir aux infections ultérieures par des réactions croisées. Par exemple, les adultes qui n'ont jamais été exposés au VIH-1 ont dans leur répertoire des cellules T mémoire qui réagissent avec des peptides de VIH présentés à la surface cellulaire par des protéines HLA ; ces cellules T sont susceptibles d'être réveillées en cas d'infection par le VIH, comme pour d’autres microbes. La réactivité croisée provient de discrets peptides courts (8-15 acides aminés) (epitopes) qui s'insèrent dans des rainures de liaison aux peptides sur les molécules HLA de classe I ou II à la surface cellulaire et sont alors reconnus par les cellules T. Dans les séquences de microbiote, il existe de nombreux alliages parfaits et presque parfaits à des epitopes de peptides viraux connus, tels que ceux du VIH-1. Ceux-ci peuvent donc facilement des cellules T mémoire spécifiques d’épitopes pathogènes que la personne n'a jamais rencontrés.
Des bactéries filamenteuses segmentées dans l'intestin sont nécessaires pour le développement des cellules Th17 et les Clostridium spp induisent des T-reg coliques. Les souris axéniques ont des défauts immunologiques : moins de plaques de Peyer, moins de petits follicules lymphoïdes et elles ont des anomalies dans les sites producteurs de tissu lymphoïde de l'intestin grêle. Cette immunodéficience peut être corrigée en quelques jours en introduisant une seule souris au microbiote intestinal normal dans une cage de souris axéniques. Ces modèles animaux confirment que le microbiome favorise le développement de cellules T et B mémoire.
Des événements similaires se produisent pour les cellules B. Les antigènes glucidiques des groupes sanguins ABO réagissent de manière croisée avec les antigènes bactériens de l'intestin et stimulent les réponses des anticorps IgM. Des anticorps de la protéine gp41 du VIH-1 peuvent être dérivés de cellules B dont les récepteurs réagissent de façon croisée avec une protéine d’Escherichia coli.
À mesure que l'enfant grandit, son répertoire immunitaire est aussi façonné par les infections intercurrentes et les vaccinations. Les infections sont documentées par des maladies symptomatiques diagnostiquées, mais pour de nombreux virus, comme la grippe, l'infection peut être infraclinique, mais suffisante pour stimuler ou stimuler les réponses immunitaires. Généralement, la protection offerte par la réponse immunitaire, aussi bien les anticorps que les lymphocytes T, est très puissante. La plupart des infections infantiles surviennent une seule fois et la protection est permanente.
Le maintien de la mémoire à long terme des cellules B est remarquable étant donné que l'immunoglobuline IgG a une demi-vie in vivo d'environ 25 jours. Les cellules plasmatiques produisant des anticorps migrent vers la moelle osseuse, où elles vivent très longtemps. De plus, il peut y avoir une régénération continue des cellules B mémoire en contact avec des cellules T antigéniques et des T helper. Les antigènes particulaires persistent pendant des années dans les ganglions lymphatiques, au sein de cellules dendritiques folliculaires. La persistance de l'antigène et les antigènes réagissant de manière croisée aident probablement à maintenir ces cellules B en vie, se divisant occasionnellement et en sécrétant des anticorps.
Il est remarquable qu'une mère puisse transférer assez d'anticorps pour protéger son nourrisson, alors qu’elle a été infectée 20-30 ans auparavant. Cette transmission d’anticorps protecteurs d'une mère à son enfant est extrêmement importante, surtout dans les environnements où plus de 15% des nourrissons meurent d'infection. Paradoxalement, une mère qui aurait évité une infection infantile dangereuse, en raison de l'immunité de la population, peut mettre son enfant en danger en étant incapable de lui transférer les anticorps protecteurs spécifiques.
Il existe un grand nombre d'infections chroniques asymptomatiques, principalement virales, qui provoquent des réponses immunitaires. Les exemples sont le cytomégalovirus (CMV), le virus d'Epstein-Barr (EBV) et Mycobacterium tuberculosis (Mtb), mais leur liste complète est longue et en progression. L'EBV, le CMV et le Mtb provoquent des réponses de lymphocytes T CD4 et CD8 très fortes chez l'homme. La réponse des lymphocytes T CD8 spécifiques du CMV peut donner lieu à des expansions de cellules T oligoclonales atteignant plus de 10% des lymphocytes T CD8 circulants. Ces cellules T sont importantes car elles contrôlent le virus ; leur épuisement, par traitements immunosuppresseurs par exemple, peut activer les infections (Mtb, EBV, CMV), avec des conséquences dévastatrices.
L'évolution des réponses des anticorps dans les lymphocytes B a été examinée en détail. En bref, les cellules B naïves avec des récepteurs d'anticorps spécifiques de l'immunogène lient l'antigène dans les ganglions lymphatiques et reçoivent un signal partiel. L'antigène lié est internalisé et digéré dans les lysosomes. Quelques peptides résultants se lient aux molécules HLA de classe II de cette cellule et sont ensuite présentés à la surface cellulaire, où des cellules T helper folliculaires T avec des récepteurs de lymphocytes T appropriés répondent et délivrent d'autres signaux, dont IL-21, à la cellule B. Ces signaux déclenchent la division des cellules B, la commutation de classe de gènes d'anticorps et l'hypermutation somatique. Les cellules B qui expriment l'anticorps muté se liant à l'immunogène avec une affinité plus élevée sont alors favorisées. La sélection de meilleurs anticorps de liaison se poursuit au cours des mois, aboutissant finalement à un anticorps à haute affinité provenant de gènes de lignée germinale fortement mutés. Les anticorps à haute affinité sont plus efficaces pour neutraliser ou opsoniser les microbes envahissants et leurs produits pathogènes.
Le processus d'hypermutation somatique ne se produit pas dans les lymphocytes T, même s'ils ont des gènes de récepteur de cellules T (TCR) de type anticorps, car il n'y a aucun avantage à avoir un récepteur de lymphocytes T à haute affinité. La liaison du TCR au complexe peptide-HLA sur une cellule présentatrice d’antigène a une faible affinité. Elle est renforcée par plusieurs paires corécepteur-ligand non spécifiques de l'antigène, donnant au lymphocyte T un signal de division et de fonctionnement.
En réponse à un défi immunitaire, les lymphocytes T et B répondeurs peuvent se développer de façon transitoire jusqu'à atteindre des taux de plus de 10% de toutes les cellules T circulantes, mais ils décroissent rapidement par mort cellulaire induite par l'activation et par attrition sur une plus longue période. Ainsi, lorsque le pathogène est contrôlé, puis disparaît, certaines cellules T et B mémoire persistent pendant une longue période en nombre dépassant de loin le nombre de cellules naïves et de T mémoire naïves présentes avant l'infection.
À mesure que l'individu vieillit, il développe un répertoire comprenant des lymphocytes T et B mémoire issus d’infections et vaccins antérieurs, mais aussi un répertoire de mémoire naïve façonné par l'exposition au microbiome, aux antigènes alimentaires et aux antigènes inhalés. Etant donné la grande complexité des répertoires des lymphocytes T et B, le caractère stochastique du choix des cellules qui répondront à un stimulus donné, et les mutations somatiques des cellules B, la composition précise sera différente chez chaque individu, même chez les jumeaux monozygotes. Ceci ajouté à la grande variabilité génétique dans les réponses individuelles, déterminée par les gènes hautement polymorphes du système HLA et par les gènes de l'immunité innée, il n'est pas surprenant que les réponses immunitaires d'un seul adulte varient considérablement.
a) Grossesse
Il est hors de notre propos d’étudier l'immunologie de la grossesse en détail. Cependant, la réussite de la reproduction est d'une importance évolutionniste majeure, et elle affronte des problèmes immunologiques. On a déjà vu comment le nouveau-né conserve des mécanismes par lesquels le fœtus a minimisé ses réponses immunitaires à la mère. Un casse-tête plus important est de savoir comment la mère tolère un greffon semi-allogénique sans le rejeter et sans atteindre un niveau d'immunosuppression aussi fort que celui qui empêche un rejet de greffe. Certaines caractéristiques, dans le trophoblaste au site d'implantation initiale, et dans le placenta, subvertissent la réponse immunitaire normale de rejet de greffe. Ces caractéristiques comprennent : l'expression des seuls antigènes HLA non-polymorphiques non classiques sur le trophoblaste, la suppression immunitaire locale induite par infiltration de cellules NK, des monocytes et des cellules T régulatrices, et l'inhibition de l'activation des lymphocytes T par catabolisme du tryptophane. Au moment de l'implantation, une réponse inflammatoire locale stabilise le site placentaire stable. Preuve que la mère modifie l'équilibre de ses réponses de cellules T vers la voie Th2 plutôt que Th1. Ainsi, les femmes enceintes peuvent présenter des rémissions de maladies auto-immunes et sont plus sensibles aux complications sévères de la grippe ou autres infections. Cette modulation immunitaire, nécessaire au bien-être du fœtus, peut occasionnellement être nocive pour la mère.
b) Malignité et immunité
Le rôle principal du système immunitaire est de protéger contre les infections. D'autres rôles tels que la destruction des cellules mutées peuvent être très importants, mais plus encore dans la vieillesse, après la reproduction. De nombreuses tumeurs induisent des lymphocytes T spécifiques d’antigènes tumoraux en se liant à des récepteurs-clés tels que PD-1 ou CTLA4, et les nouveaux traitements qui bloquent ces interactions récepteur-ligand ont un grand potentiel thérapeutique. Cependant, les effets secondaires de telles thérapies et du transfert passif de lymphocytes T anti-cancéreux induisent des réactions auto-immunes, suggérant un équilibre entre des réactions anti-auto-immunes prévenant le cancer et provoquant l'auto-immunité. Dans la vie adulte, l'équilibre fonctionne habituellement, mais un tiers des humains occidentaux développent un cancer, habituellement tardif dans la vie, tandis que 5-10% développent une maladie auto-immune clinique, ainsi l'équilibre est subtil et peut changer au fil du temps. Le système immunitaire faiblissant dans la vieillesse peut améliorer l'auto-immunité, mais aux dépens d'un risque accru de cancer.
Les micro-organismes provoquent environ un quart de tous les cancers (par exemple EBV, virus de l'hépatite B et C, virus du papillome humain et Helicobacter pylori). Les réponses spécifiques des lymphocytes T maintiennent normalement ces microbes en échec. Cependant, si l'immunité est altérée par le vieillissement, par un traitement immunosuppresseur ou par certaines infections tel que le SIDA, ces cancers émergent alors.
Par conséquent, après avoir développé une réponse immunitaire pleinement efficace dans la petite enfance, celle-ci mûrit à mesure que la mémoire s'accumule, elle maintient la santé de l'individu pendant les périodes critiques de la vie, y compris la grossesse. Le système immunitaire protège non seulement contre les infections potentiellement mortelles, mais aussi contrôle un certain nombre d'infections persistantes, dont certaines peuvent causer un cancer. Il peut également détruire des cellules mutantes au potentiel malin. Il peut aussi être sur-réactif et causer une maladie auto-immune ou une allergie, c’est prix à payer pour l'avantage global de ce système.
4 / Le déclin immunitaire avec l'âge
Avec les années, le système immunitaire subit un profond remodelage et un déclin dont l’impact est majeur sur la santé et la survie. Cette sénescence immunitaire prédispose les personnes âgées à un risque plus élevé d'infections virales et bactériennes aiguës. De plus, les taux de mortalité de ces infections sont trois fois plus élevés chez les patients âgés que chez les adultes plus jeunes. Les maladies infectieuses restent la quatrième cause de décès chez les personnes âgées en Occident. En outre, les réponses immunitaires aberrantes chez les personnes âgées peuvent exacerber l'inflammation, ce qui pourrait contribuer à d'autres fléaux de la vieillesse: cancer, maladies cardiovasculaires, AVC, Alzheimer et démence.
Au cours d'une épidémie saisonnière de grippe, environ 90% des décès excédentaires se produisent chez les personnes de plus de 65 ans. En outre, les faibles réponses immunitaires expliquent une diminution de l'efficacité des vaccins. La sénescence immunitaire entraîne également la réactivation de virus latents, tels que le virus varicelle-zona, provoquant le zona et la névralgie chronique.
La détérioration du système immunitaire avec l'âge peut compromettre l'équilibre homéostatique entre le microbiote et l'hôte. Ainsi, la réduction de la diversité bactérienne dans l'intestin a été corrélée avec la diarrhée à Clostridium difficile, une complication majeure chez les personnes âgées hospitalisées. De plus, les écarts par rapport au profil du microbiote intestinal des jeunes, sont associés à une inflammation intestinale. Avec l’âge, l’augmentation de pathobiontes pro-inflammatoires et la diminution d’espèces microbiotiques immunomodulatrices, favorisent et maintiennent les troubles inflammatoires.
Dans le même temps, le système immunitaire vieillissant ne parvient pas à maintenir une tolérance totale aux auto-antigènes, avec une incidence accrue de maladies auto-immunes. Cela est probablement dû à une lymphopénie, entraînant une prolifération lymphocytaire homéostatique, ainsi qu'une diminution de la fonction des lymphocytes T régulateurs et une diminution de la clairance des cellules apoptotiques par les macrophages.
Le cancer est le plus fréquent chez les personnes âgées. L'âge médian du diagnostic dans nos pays est de 70 ans. La raison principale est évidemment l'accumulation de dommages cellulaires et génétiques tout au long de la vie. Cependant, étant donné le rôle de la réponse immunitaire dans le contrôle des cancers, la réduction des fonctions immunitaires chez les personnes âgées doit contribuer à l’augmentation du risque. Cette altération immunitaire est en contradiction apparente avec l'augmentation de l'auto-immunité car les anticorps anti-tumoraux peuvent s’apparenter à des réponses contre soi. Cependant, le déclin général du système immunitaire prévaut probablement et les tumeurs ne sont plus rejetées aussi efficacement. En outre, l'inflammation accrue avec l'âge facilite l'émergence du cancer.
L'augmentation de la morbidité due au déclin du système immunitaire est une conséquence directe de la dérégulation de l'immunité adaptative chez les personnes âgées. Le faible nombre de cellules T naïves par rapport aux cellules T est une conséquence de la réduction de production thymique, car le thymus a régressé. En conséquence de cette lymphopénie induite par l'âge, les lymphocytes T prolifèrent et augmentent le compartiment de 'mémoire virtuelle', mais en même temps, la capacité à établir la mémoire immunologique en réponse aux antigènes de novo est réduite, compromettant les vaccinations. Les fonctions telles que la production de cytokines par les lymphocytes T CD4 et CD8 sont altérées, l'expression des marqueurs-clé de surface et le ratio CD4 + vers CD8 + est inversé. Le développement des de lymphocytes T qui contrôlent les virus latents tels que l'EBV et le CMV, réduisent l'espace pour les lymphocytes T CD8 + spécifiques d'autres virus potentiellement mortels, tout cela majoré par la baisse de production de cellules T naïves d’origine thymique.
Alors que le nombre de cellules B périphériques ne diminue pas avec l'âge, la composition de ce compartiment change. Comme les cellules T, les cellules B naïves sont remplacées par des cellules mémoire expérimentées, dont certaines sont «épuisées» (CD19 + IgD-CD27-), perdant leur affinité et ayant un isotype muté.
En général, les changements dans les compartiments des cellules T et B nuisent à la réponse immunitaire aux nouvelles infections virales aiguës et latentes ainsi qu’aux vaccinations.
La réponse immunitaire innée diminue également avec l'âge. Il y a des changements dans le nombre de cellules innées, avec un biais d'hématopoïèse en faveur des lignées myéloïdes. Le neutrophile sénescent est moins fonctionnel avec une diminution de sa capacité phagocytaire et une production de superoxyde due en partie à une diminution de l'expression des récepteurs Fcγ. Ces macrophages vieillissants ont un déficit respiratoire, une fonction phagocytaire réduite et une expression HLA II également réduite. L'élimination immunologique d’un nombre croissant de cellules sénescentes et apoptotiques est donc compromise et contribue au phénotype pro-inflammatoire. En effet, lorsque des cellules sénescentes sont été retirées artificiellement chez des souris âgées, les animaux vivent plus longtemps et en meilleure santé.
Le changement le plus critique lors du vieillissement du système immunitaire inné vieillissant est probablement l'augmentation des cytokines pro-inflammatoires IL-1β, IL-6, IL-18 et TNFα. L'inflammation de bas grade qui en résulte contribue probablement à l'athérosclérose, à la démence et au cancer, liant inextricablement l'inflammation et le vieillissement des autres tissus.
La base cellulaire et moléculaire de la sénescence immunitaire n'est pas encore bien comprise. Trois phénotypes caractérisent les cellules sénescentes :
- Attrition des télomères accompagnant chaque cycle de prolifération, conduisant à l’arrêt des divisions cellulaires ou à une «sénescence réplicative» ;
- Dysfonction mitochondriale augmentant la charge des radicaux libres de l’oxygène.
- Phénotype sécrétoire associé à la sénescence (SASP), défini comme la sécrétion de cytokines pro-inflammatoires, de chémokines et de protéases par des cellules sénescentes
Bien que la plupart des données aient été obtenues dans les fibroblastes, les cellules immunitaires sénescentes présentent probablement des caractéristiques similaires. Tout ceci a un impact sur les cellules mitotiques actives, conduisant à un épuisement ou arrêt des divisions (par exemple des cellules souches hématopoïétiques - HSC ou cellules T) et sur les cellules immunitaires postmitotiques en provoquant une dysfonction cellulaire (par exemple des neutrophiles).
L'attrition des télomères est un mécanisme protecteur contre le cancer, car chaque cycle de prolifération est susceptible d'introduire des mutations. Seuls les lymphocytes épithéliaux et les cellules souches, y compris hématopoïétiques (HSC) expriment la télomérase (enzyme de rallongement des télomères chez l'adulte, nécessitant un subtil équilibre avec le risque de cancer. Les lymphocytes T mémoire et HSC se divisent rarement, pour minimiser l'attrition des télomères, mais de manière fiable, soit en réponse à l'infection (lymphocytes mémoire), soit pour le renouvellement des tissus (cellules souches) pendant toute la durée de vie. Les CD27-CD28 sénescents au stade terminal ont les télomères les plus courts et ont une moindre prolifération après activation, mais présentent néanmoins des fonctions effectrices puissantes. Ces cellules s'accumulent dans la vieillesse et chez les patients atteints de maladies auto-immunes et d'infections virales chroniques. La deuxième caractéristique des vieilles cellules est l'augmentation du dysfonctionnement mitochondrial et les dommages oxydatifs qui en résultent sur les protéines et l'ADN. Chez la souris, l’administration d’antioxydants peut restaurer ces fonctions. Le stress oxydatif provoque des cassures d'ADN et peut être la cause de l'attrition des télomères, ce qui relie ces deux premières causes du vieillissement. L'accumulation de lésions oxydatives pourrait être due à un déclin de la fonction lysosomale et autophage. L'autophagie, dégradant le matériel cytoplasmique et le distribuant aux lysosomes, diminue avec l'âge, y compris dans les cellules T CD8 + humaines. Les souris sans autophagie dans leur système hématopoïétique présentent un système hématopoïétique prématurément vieilli. A défaut de mémoire, les réponses des cellules T à la vaccination antigrippale observées chez les personnes âgées peuvent être restaurées avec un composé induisant l'autophagie. Une découverte plus récente, dans ces changements fondamentaux des vieilles cellules, est l'acquisition de la SASP, ce qui contribue à l'augmentation de sécrétion de cytokine pro-inflammatoire et de l'inflammation de bas grade.
5/ Evolution du système immunitaire humain
En tant qu'espèce à vie longue, les humains ont développé des mécanismes d'immunité innée et de mémoire immunologique pour survivre aux infections récurrentes. Cependant, au cours de la vie d'un individu, ces mécanismes immunitaires changent, d'abord pour s'adapter au passage de fœtus à nourrisson, puis pour mûrir et se développer pendant la croissance, changer subtilement pendant la grossesse et finalement diminuer lors de la sénescence. La production de cellules lymphoïdes naïves et la capacité de former une nouvelle mémoire immunologique devient de moins en moins importante quand l'individu âgé a rencontré et mémorisé de nombreux agents pathogènes au cours de sa vie. Il est possible que le biais myéloïde et la sécrétion accrue de cytokines pro-inflammatoires au cours du vieillissement soient essentiels pour améliorer la phagocytose d'un nombre croissant de cellules sénescentes, ce qui soulève la question de savoir si les changements dans le système immunitaire vieillissant peuvent avoir un but.
Le système immunitaire a été principalement modelé par l'évolution pour répondre efficacement aux infections aiguës chez les jeunes, s'adapter à la grossesse et transmettre la protection aux nourrissons, il est aussi adapté pour faire face à de nombreuses infections chroniques pendant des décennies. Outre la lutte contre les virus, les bactéries, les champignons et les parasites, le système immunitaire assume également d'autres rôles tels que la réparation des tissus, la cicatrisation des plaies, l'élimination des cellules mortes et cancéreuses, et la formation du microbiote intestinal sain. En supposant l'absence de pression sélective majeure sur les êtres humains au-delà de l'âge de la reproduction, Le prix à payer, pour ces caractères génétiques assurant une bonne condition physique au début du développement, sont des phénotypes immunologiques tels que l'inflammation chronique. Le vieillissement massif et la longue durée de vie sont des phénomènes très récents d’un environnement optimisé. Comme proposé par Hayflick, le vieillissement peut être un artefact de la civilisation, et par conséquent, les changements dans le système immunitaire vieillissant, pourraient simplement être une conséquence de l'exposition antigénique évolutive et imprévisible au cours de la vie d'un individu.
Sous certains aspects, le système immunitaire d’un organisme vieilli ressemble à celui du nouveau-né, avec une activité antimicrobienne réduite par les neutrophiles et les macrophages, une réduction de la présentation des antigènes par les cellules dendritiques et une diminution des NK, ainsi que des réponses lymphocytaires adaptables quelque peu compromises. Aussi bien le système immunitaire très jeune que le système immunitaire ancien sont par conséquent également déficients pour faire face à une infection virale typique telle que la grippe, alors que l'organisme adulte jeune (hors grossesse) semble parfaitement adapté à ce défi (figure 1). L'évolution du système immunitaire chez un même un individu est bien le reflet du rôle central du jeune adulte et de son potentiel procréateur pour la survie de l'espèce.
Traducton de Luc Perino
Bibliographie
Simon AK, Hollander GA, McMichael A
Evolution of the immune system in humans from infancy to old age
Proc Biol Sci. 2015 Dec 22;282(1821):20143085
DOI : 10.1098/rspb.2014.3085
Et pour aller plus loin
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Evolution rapide des bactéries pathogènes - Abstract Depuis le premier séquençage complet d’un organisme libre, Haemophilus influenzae, la [...]
L'auto-immunité et le sexe - L’auto-immunité est-elle un problème de sexe ? Abstract Les maladies auto-immunes [...]
Évolution des régimes alimentaires au cours de l'hominisation - Ne sont mentionnés ici que les points sur lesquels existe un consensus Thème N° 1 - Régime et [...]
Environnement de la grossesse, épigénétique et sensibilité aux maladies - Il existe désormais de nombreuses preuves épidémiologiques entre les expositions [...]
Coopération et alloparentalité - Stressé par la parentalité ? L’évolution peut expliquer pourquoi Qu’est-ce que les fourmis [...]
Vous aimerez aussi ces humeurs...
La science prise en grippe - Comme chaque année, l’assurance-maladie envoie les documents de prise en charge gratuite du [...]
La mort dans le P.I.B. - D’après le CNPS, la santé représente 11% du PIB. Diverses études de caisses d'assurance [...]
Très chères minutes de vie - En cancérologie de l’adulte, la chirurgie et la radiothérapie ont permis de prolonger la [...]
Cas clinique de la France - Le diagnostic d’un patient résulte souvent du « flair clinique » basé sur l’expérience [...]
Spermatozoïdes sous le charme - Les catastrophes écologiques à venir emplissent nos médias : réchauffement climatique, [...]
La phrase biomédicale aléatoire
Il faut se méfier de ceux qui cherchent à nous convaincre par d'autres voies que la raison, autrement dit des chefs charismatiques. Nous devons bien peser notre décision avant de déléguer à quelqu'un d'autre le pouvoir de juger et de vouloir à notre place.
― Primo Levi
