Microchimérisme fœtal
dernière mise à jour le 13/02/2021
La présence de cellules fœtales a été associée à des effets positifs autant que négatifs sur la santé maternelle. Ces effets paradoxaux peuvent être dus au fait que les intérêts sélectifs de la mère et de sa progéniture peuvent être communs dans certains domaines et contradictoires dans d'autres, ce qui peut avoir conduit à l'évolution de phénotypes microchimériques fœtaux capables de manipuler les tissus maternels. Nous utilisons la théorie de la coopération et du conflit pour générer des prédictions vérifiables dans les domaines où le microchimérisme fœtal peut améliorer la santé maternelle et ceux dans lesquels il peut être préjudiciable.
Ce cadre de travail suggère que les cellules fœtales peuvent fonctionner à la fois de manière à contribuer à l’entretien somatique maternel (par exemple cicatrisation des plaies) et de manière à améliorer la transmission des ressources à la descendance (par exemple la production de lait). Dans cette revue, nous utilisons un cadre évolutionniste pour faire des prédictions testables sur le rôle du microchimérisme fœtal dans la lactation, la fonction thyroïdienne, les maladies auto-immunes, le cancer, les émotions de la mère et sa santé psychique.
Introduction
La fonction des cellules fœtales dans les tissus maternels est inconnue
Les interactions mère-enfant sont souvent considérées comme uniquement coopératives, chaque partie ayant un intérêt dans la survie et le bien-être de l’autre. Cependant, les interactions parents-enfants sont caractérisées à la fois par la coopération, car le partage des gènes donne une valeur sélective positive à l'investissement maternel dans sa progéniture [1] ; et aussi par les conflits, parce que parents et progéniture ne partagent pas tous leurs gènes et que l’avenir de la reproduction maternelle peut être affecté négativement par un trop grand investissement maternel dans la progéniture en cours [2]. Dans le cadre de la grossesse, les conflits de ressources ont conduit à l'évolution d’une manipulation fœtale des systèmes maternels pour augmenter les ressources transférées par le placenta, et à l'évolution de contre-mesures maternelles pour limiter les flux de ressources [3, 4]. Ce conflit est instancié à travers un certain nombre de mécanismes, dont l'empreinte génomique et la production d'hormone placentaire [3, 5].
L'escalade du conflit entre les systèmes fœtaux et maternels pour l'allocation des ressources a été proposée comme une explication de plusieurs pathologies de la grossesse, dont le diabète gestationnel et la pré-éclampsie [3, 5]. Ici, nous étendons le concept du conflit mère- progéniture au-delà de l'utérus jusqu’aux interactions entre les cellules fœtales et les tissus maternels dans tout le corps aussi bien pendant la grossesse qu’après.
Pendant la grossesse, il y a un flux bidirectionnel de cellules fœtales et maternelles (Fig. 1). Le transfert de ces cellules est asymétrique, avec plus de cellules fœtales transférées à la mère que l'inverse [6]. Les cellules fœtales augmentent en fréquence dans le corps de la mère parallèlement à l'âge gestationnel [7, 8], et elles ont été identifiées dans le sang et les tissus maternels pendant des décennies après la naissance [9, 10]. Après l'accouchement, le système immunitaire de la mère élimine certaines cellules fœtales mais pas toutes, en induisant leur apoptose [11]. Le microchimérisme maternel (transfert de cellules maternelles vers le fœtus) est également constaté couramment dans les tissus fœtaux [12, 13], et peut aussi persister pendant des décennies après la naissance [14]. Le microchimérisme n’est pas limité à un échange bidirectionnel exclusif entre cellules maternelles et fœtales, car des cellules de frères et sœurs plus âgés et même des cellules de grand-mère maternelle peuvent également être transférées au fœtus [15].
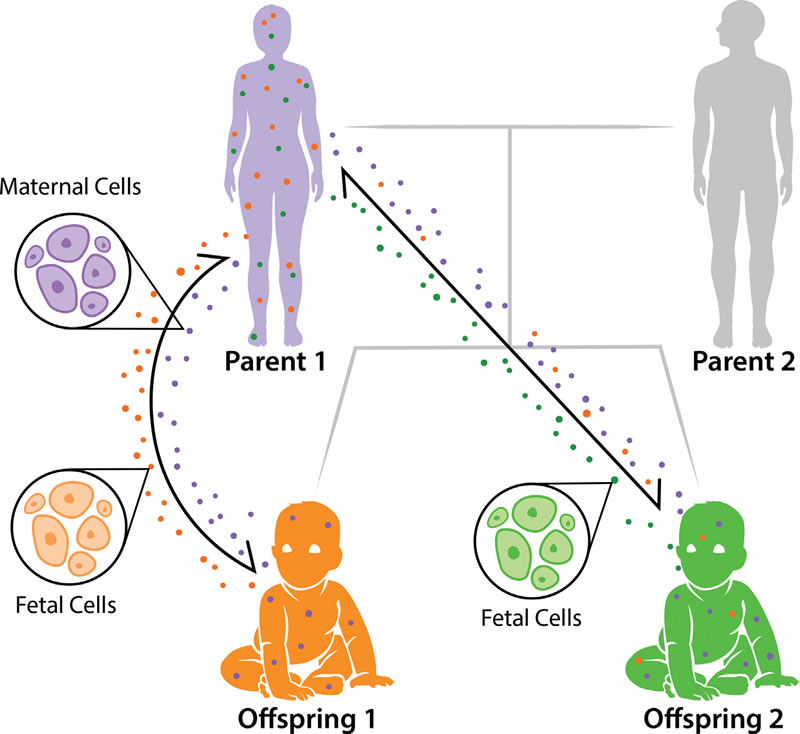
Figure 1 : Pedigree de microchimérisme.
Le microchimérisme est un échange bidirectionnel des cellules fœtales et de cellules maternelles pendant la grossesse. Les cellules fœtales (points verts et oranges) circulent dans le corps maternel et augmentent en quantité tout au long de la période de gestation. De même, chaque fœtus hérite de cellules maternelles (points violets). Il a été prévu que les plus jeunes frères et sœurs pourraient également obtenir des cellules de leurs aînés [15], comme représenté avec les cellules de l’enfant 1 (points orange) circulant dans corps de l’enfant 2.
La littérature sur le microchimérisme fœtal et la santé maternelle est paradoxale, avec certains articles concluant que le microchimérisme fœtal contribue à amoindrir la santé maternelle et d’autres concluant qu’il l’améliore. Par exemple, on a suggéré que les cellules fœtales pouvaient jouer un rôle dans la cicatrisation des plaies de la mère [16, 17], mais elles ont également été corrélées à des complications de la grossesse, dont un caryotype fœtal atypique (syndrome de Down par exemple), la pré-éclampsie, les fausses couches, et la naissance prématurée [18-22]. Des cellules fœtales ont aussi été identifiées sur les sites de tumeurs, notamment du sein, du col de l'utérus, de la thyroïde ainsi que des mélanomes [23]. Ici nous passons en revue ces résultats contradictoires et décrivons comment les cadres de coopération et de conflit peuvent aider à élucider les fonctions tant proximales que distales des cellules fœtales dans les tissus maternels (tableau 1).
Le microchimérisme est commun chez les mammifères placentaires
D’un large point de vue phylogénétique, le microchimérisme est une forme spéciale de chimérisme défini comme un organisme composé de plus d'un individu génétiquement distinct. Bien que le chimérisme à grande échelle soit relativement rare dans la nature [24], le microchimérisme est commun chez les mammifères placentaires. Les placentas présentent un haut degré de diversité physiologique et morphologique [25], et une partie de cette diversité placentaire pourrait être la conséquence de l'évolution des conflits entre la mère et sa progéniture pour le transfert des ressources [4]. Un des paramètres les plus importants de la variation placentaire est la profondeur de l'insertion des cellules trophoblastiques. Le placenta humain est de type hémochorial, et il est très invasif [26]. Cet envahissement placentaire améliore le transfert des nutriments de la mère au fœtus, mais il permet également un plus grand échange de cellules maternelles et fœtales [26]. Le microchimérisme a été détecté dans tous les types placentaires (hemochorial, épithélial, endothélial), chez les primates [14], [27] les chiens, les vaches [28], et les souris [8, 29]. Comme les cellules du trophoblaste fœtal qui envahissent l’endomètre maternel pendant la grossesse, les cellules fœtales circulant dans le sang de la mère peuvent coloniser d'autres tissus et persister dans le corps de la mère après l’accouchement.
| Tableau 1. Explications proximales, développementales, évolutionnistes et phylogénétiques du microchimérisme | ||
| Niveaux d'explication | Définition | Explication du microchimérisme fœtal |
| Proximal | La cause immédiate de la pathologie | La placentation permet le transfert d'un petit nombre de cellules entre le fœtus et la mère |
| Développemental | Comment la pathologie survient suite à des évènements de vie individuelle | Les preuves suggèrent que le microchimérisme fœtal commence bien avant la formation complète du placenta, probablement dès le début de la placentation [26, 111] |
| Evolutionniste | Comment la sélection naturelle et d'autre mécanismes évolutionnistes (dérive, migrations) ont laissé l'organisme vulnérable aux maladies | Le conflit génomique materno-fœtal, par l'empreinte génétique, peut avoir permis la sélection d'un taux élevé de cellules fœtales microchimériques |
| Phylogénétique | Quand, dans l'histoire de l'évolution, est apparue la vulnérabilité aux maladies ? | Jusqu'ici, le microchimérisme n'a été détecté que chez les mammifères euthériens [14, 27–29], suggérant qu'il est apparu au plus tard chez leur ancêtre commun, il ya approximativement 93 millions d'années [112] |
Compte tenu de leurs origines évolutionnistes et phylogénétiques, les cellules fœtales peuvent avoir une fonction similaire à celle du placenta conçu pour transférer des ressources de l'organisme de la mère à celui de sa progéniture dans l’utérus [3, 5], la physiologie des cellules fœtales dans le tissu maternel peut améliorer le transfert des ressources à la descendance après l'accouchement comme, par exemple, l'amélioration de la lactation ou la transmission de chaleur. Ce transfert de ressources peut être doublement bénéfique pour la valeur sélective de la mère et de ses enfants, ou inversement, la manipulation du fœtus peut pousser les tissus maternels au-delà de l'optimum pour la mère [2] conduisant à des conflits d’allocation de ressources. Les cellules fœtales peuvent également procurer des avantages importants aux tissus maternels pour la cicatrisation des plaies ou pour la maintenance somatique en raison de leur nature proche des cellules souches.
Dans cet article, nous utilisons une approche évolutionniste pour identifier les domaines dans lesquels nous devons nous attendre à de la coopération ou à des conflits entre cellules fœtales et tissus maternels. Nous utilisons ensuite ce cadre pour faire des prédictions sur les conditions de ces effets positifs ou négatifs sur la santé maternelle. Nous examinons les données actuelles sur les effets du microchimérisme sur la santé maternelle, l'identification des tissus dans lesquels on a trouvé un microchimérisme fœtal et la description des fonctions de chacun de ces tissus. Le cadre évolutionniste et fonctionnel du microchimérisme fœtal que nous présentons ici explique certaines des conclusions contradictoires de la littérature et identifie les lacunes dans notre compréhension permettant d’orienter de futurs travaux.
Coopération et conflits se produisent entre cellules fœtales et tissus maternels
Il existe trois hypothèses principales sur le rôle des cellules fœtales sur la santé maternelle : (1) les cellules fœtales sont délétères, ce qui entraîne une réponse inflammatoire qui
peut endommager les tissus de la mère ; (2) les cellules fœtales sont protectrices et aident à réparer et à maintenir les tissus maternels ou (3) les cellules fœtales sont simplement passagères, sans aucun effet sur la santé maternelle [30]. Ces hypothèses peuvent ne pas être mutuellement exclusives. Le cadre de la coopération et des conflits fait certaines prédictions sur les conditions dans lesquelles les cellules fœtales peuvent avoir des effets positifs ou négatifs sur la santé maternelle.
Coopération pour la survie de la progéniture et la maintenance somatique maternelle
L’investissement parental est une part importante des stratégies humaines d’histoire de vie
[31] pour la survie et le succès ultérieur de la progéniture. Cela commence dans l'utérus et dure longtemps après la naissance. Les êtres humains ont des niveaux très élevés d’investissement parental post-partum par rapport à d'autres espèces, et ils ont clairement des adaptations pour l'investissement parental qui comprennent l'allaitement mais aussi le partage étendu de la nourriture [32], tous deux facilités par l'attachement émotionnel et le lien [33]. Parents et enfants bénéficient mutuellement de leur survie, avec les intérêts de la mère alignés sur ceux de sa progéniture en raison des avantages directs de valeur sélective (à savoir le renforcement du succès reproducteur des parents) ; et les intérêts de la progéniture étant alignés sur ceux de la mère en raison de bénéfices directs et indirects [5]. Nous prévoyons que le microchimérisme devrait être associée à une meilleure santé de la mère quand il est avantageux pour le fœtus d’améliorer la santé maternelle à un coût nul ou faible pour lui-même, par exemple dans la transmission de cellules souches fœtales qui pourraient favoriser la maintenance somatique (à savoir la réparation des tissus maternels ou le remplissage de niches de cellules souches).
Le conflit surgit au-delà des allocations optimales de ressources à l’enfant.
Les intérêts de la progéniture entraînent souvent des niveaux de transmission de ressources plus élevés que ce qui est optimal pour la santé de la mère, conduisant probablement à la sélection de phénotypes cellulaires fœtaux microchimériques aptes à manipuler les tissus maternels pour augmenter le transfert de ressources à la progéniture. Une approche de la compréhension des fonctions des cellules fœtales dans les tissus maternels est de les considérer comme parallèles aux fonctions du placenta pendant la grossesse. Elles peuvent fonctionner comme une extension du placenta, aidant à coordonner la manipulation maternelle pour un meilleur transfert des ressources à la descendance. Après la grossesse, les cellules fœtales peuvent jouer un rôle important dans l’investissement maternel continu dans sa descendance, en manipulant la lactation, la thermorégulation, et les systèmes d'attachement. Ce cadre prévoit que les cellules fœtales devraient être plus fréquentes dans les tissus aptes à ces transferts de ressources, par exemple, le sein, la thyroïde et le cerveau (figure 2), et que leur présence dans ces tissus peut être corrélée à un plus faible état de santé de la mère.
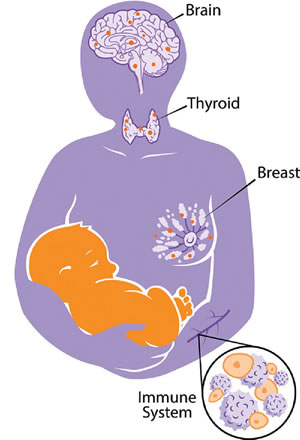
Figure 2 : Jeu de tir à la corde entre mère et progéniture.
La théorie de la coopération et du conflit peut élucider le rôle paradoxal des cellules fœtales microchimériques sur la santé maternelle. Les tissus impliqués dans l’allocation de ressources, tels que le cerveau, la thyroïde et les seins sont probablement des réservoirs de cellules fœtales (représentées par des points orange dans les tissus maternels). En outre, le système immunitaire maternel est susceptible de jouer un rôle actif dans les interactions mère/fœtus. Les résultats des négociations fœto-maternelles (jeu de tir à la corde) à l’intérieur de ces tissus sont importants pour la santé et le bien-être de la mère.
| Jeu de tir à la corde entre mère et progéniture | ||
| Intérêts de la progéniture | Intérêts de la mère | |
| cerveau | régulation à la hausse des systèmes qui soutiennent l'investissement parenal et le lien | Moduler les systèmes qui soutiennent l'invetsissement parental et optimiser les allocations de ressources entre l'enfant présent et les suivants |
| Thyroïde | Augmenter la production de chaleur | Réguler la production de chaleur à des niveaux qui optimisent l'allocation des ressources à cette progéniture et aux suivantes |
| Seins | Augmenter la quantité et la qualité de lait | Moduler la production de lait pour en optimiser l'allocation à tous les enfants présents et à venir |
| Système immunitaire | Induction de la tolérance maternelle pour échapper à la détection et à la destruction par le système immunitaire maternel | Tolérer la matière fœtale semi-allogénique. Eliminer les cellules fœtales qui augmentent le transfert de ressources au-delà de l'optimum pour la santé maternelle et celle de sa future progéniture |
Contre-mesures maternelles et escalade du conflit
Un conflit materno-fœtal prédit non seulement l'évolution des adaptations fœtales pour améliorer le flux des ressources à la progéniture, mais aussi les contre-mesures maternelles pour limiter ce flux [3]. L’extension de ce cadre au-delà du placenta suggère que les systèmes maternels devraient s’adapter pour limiter les manipulations des cellules fœtales au détriment de la santé maternelle. Un candidat mécanisme probable de contre-mesures maternelles est le ciblage et l’élimination des cellules fœtales par les cellules immunitaires maternelles. Chez la souris, il a été démontré que les cellules fœtales peuvent être éliminées par le système immunitaire maternel [34]. La limitation des cellules fœtales peut conduire à un niveau de transfert des ressources à la progéniture plus optimal pour la mère. Ainsi la capacité du système immunitaire maternel à limiter le nombre des cellules fœtales peut avoir des effets positifs sur la santé maternelle. Toutefois, si des cellules fœtales sont capables de modifier leur phénotype et de devenir plus agressives en réponse à des contre-mesures maternelles, cela pourrait conduire à une escalade coûteuse du conflit avec des conséquences potentiellement négatives pour les deux parties.
Les cellules fœtales peuvent être en mesure de répondre à des contre-mesures maternelles
en augmentant leur taux de prolifération, en produisant des signaux qui intensifient la manipulation, ou même en ciblant la destruction de cellules immunitaires maternelles. Une étude a démontré que l'invasion de cellules trophoblastiques peut induire l'apoptose dans les lymphocytes T maternels [35], ce qui suggère que les cellules fœtales peuvent avoir elles aussi des contre-mesures sophistiquées. Cela pose une question cruciale: est-ce qu’un conflit entre tissus maternels et cellules fœtales augmente, se désamorce ou atteint une sorte de palier ? La dyade mère-fœtus est un système complexe et dynamique et il peut y avoir d'importantes différences individuelles de trajectoire. Le cadre de coopération et de conflits suggère que ce sont les situations de conflit qui sont les plus préjudiciables à la santé de la mère, par exemple le diabète gestationnel et la pré-éclampsie, tous deux attribués à l'escalade du conflit materno-fœtal au cours de la grossesse [3, 5].
Il est important de souligner ici que la coopération et les conflits entre mère et enfant n’impliquent aucune intention, comme toujours dans l’évolution, mais sont une conséquence de la sélection par divers mécanismes. L'empreinte génomique est un candidat probable, car elle permet la plasticité phénotypique et a déjà été impliquée dans un conflit materno-fœtal dans l’utérus via l'empreinte de gènes maternels et paternels dans le placenta [36].
Effets contradictoires de cellules fœtales sur la santé maternelle
Les cellules fœtales sont associées à la cicatrisation des plaies et la réponse aux blessures
Certaines cellules fœtales ont des propriétés de cellules-souches [9, 37, 38] qui peuvent
apporter des bénéfices à la mère. La reconstitution de niches de cellules souches peut améliorer la survie maternelle en compensant les effets négatifs de la perte de cellules souches et les dommages dus au vieillissement [39]. Il est dans l'intérêt sélectif de la progéniture d’améliorer la survie des mères et de contribuer à l'entretien du corps maternel. En outre, les phénotypes microchimériques fœtaux peuvent être sous pression sélective pour contribuer à la santé maternelle en améliorant la guérison des plaies. Ce qui prédit que des cellules fœtales doivent être trouvées sur les sites des plaies et que leur présence y soit bénéfique.
Plusieurs études suggèrent que les cellules fœtales peuvent jouer un rôle dans la cicatrisation maternelle. Des modèles murins ont montré des cellules fœtales migrant activement sur les sites de blessures et lésions du corps maternel [17, 40-42]. Deux de ces modèles de lésions montrent des groupes de cellules fœtales dédiées aux vaisseaux sanguins et aux sites d’inflammation, ce qui évoque une participation active à l’angiogenèse maternelle [17, 40]. De plus, chez les humains, des cellules fœtales exprimant des marqueurs de cytokératine et de collagène ont été identifiées dans les cicatrices de césariennes [16], ce qui suggère leur participation active à la cicatrisation des plaies maternelles.
En accord avec l'hypothèse selon laquelle le fœtus contribue au maintien somatique continu, des cellules fœtales ont été identifiées dans de nombreux tissus sains des femmes [10, 43-45] et des femelles de rongeurs [41, 42, 46, 47].
De plus, il existe des preuves que dans les tissus maternels, les cellules fœtales se différencient en plusieurs types cellulaires dont des cellules endothéliales [16], des neurones [47], des cellules musculaires lisses, et des cardiomyocytes [10, 48]. Des cellules mésenchymateuses d'origine fœtale ont régulièrement été détectées dans la moelle osseuse des femmes qui ont donné naissance à au moins un fils [37], et chez les femmes en bonne santé, des cellules fœtales sont présentes dans de nombreuses populations de cellules immunitaires maternelles, dont les cellules T, B et NK [49], ainsi que dans les modèles murins [38]. Ces études suggèrent que les cellules fœtales contribuent, au moins passivement, à la maintenance somatique des mères, et activement à la cicatrisation des plaies.
Des cellules fœtales se trouvent sur les sites d’allocation de ressources à la descendance.
En plus du rôle positif que les cellules fœtales peuvent jouer dans la cicatrisation et la maintenance somatique maternelle, elles peuvent jouent également un rôle négatif pour la santé de la mère, en manipulant le transfert des ressources à la descendance au-dessus de la valeur optimale pour la mère. Ci-dessous, nous étendons nos prédictions et passons en revue la littérature actuelle en ce qui concerne la présence de cellules fœtales dans les tissus impliqués dans l'allocation des ressources et l'association de ces cellules avec la santé et les maladies de la mère. La plupart des études sur l'espèce humaine ont testé la présence ou l'absence d'ADN ou de cellules mâles dans le sang ou les tissus de femmes ayant ou non déjà donné naissance à un fils. Les résultats sont également présentés dans le tableau 2.
Des cellules fœtales sont présentes dans les seins
Le lait maternel fournit des calories, des nutriments et la protection immunologique des enfants [50, 51] ; cependant, l'allaitement est coûteux pour la mère. Cela signifie qu'il peut y avoir conflit entre l'offre de lait optimale pour la mère et les intérêts qu’à l’enfant à augmenter la production [5]. Si des cellules fœtales sont capables de migrer vers la poitrine pour réguler à la hausse la production de lait, soit par des facteurs de manipulation des glandes mammaires, soit par différenciation de leurs cellules, cela bénéficierait à la progéniture. Ce qui suppose que la présence de cellules fœtales dans le sein soit associée à des niveaux plus élevés de production de lait ou à une amélioration de sa qualité, avec, dans certains cas, des résultats négatifs sur la santé de la mère [52].
Des cellules fœtales se trouvent fréquemment dans le tissu mammaire normal des femmes en post-partum. Chez les femmes en bonne santé, de l'ADN mâle a été détectée dans les glandes mammaires de plus de la moitié des femmes examinées [53]. Cependant, les résultats de la recherche actuelle sur le rôle de ces cellules dans les maladies du sein ne sont pas clairs. Des cellules fœtales ont été trouvées moins fréquemment dans le sang et les tissus de femmes ayant un cancer du sein que chez les femmes témoins saines [54-57], ce qui suggère que les cellules fœtales seraient plus souvent associées à une meilleure santé de la mère. Cependant, un modèle murin de cancer du sein a montré que les tumeurs de haut grade contiennent beaucoup plus de cellules fœtales que les tumeurs de bas grade [58] ; et des cellules fœtales ont également été trouvées dans le stroma tumoral des femmes [59]. En outre, l'association de
cellules fœtales avec le cancer du sein peut être spécifiques du sous-type, comme dans le cas du sous-type HER2 où des niveaux plus élevés de cellules fœtales ont été signalés, alors que des niveaux inférieurs sont associées à des sous-types avec récepteur œstrogène / progestérone positif [53].
Il est également possible que le microchimérisme fœtal, de par sa longue histoire de coévolution avec le corps maternel (Tableau 1), puisse désormais jouer un rôle dans la physiologie normale du sein. Les glandes mammaires des mères abritent une population de cellules souches qui contribuent au développement mammaire normal et qui peuvent être transférées au nourrisson pendant la lactation [60]. Les cellules fœtales, aux propriétés similaires aux cellules-souches, situées dans la glande mammaire pourraient répondre aux mêmes signaux maternels. On a montré in vitro que des fibroblastes fœtaux de souris se différencient en cellules épithéliales mammaires lorsqu'ils sont exposés à des hormones de lactation (insuline, progestérone et ocytocine) [61], et une glande mammaire fonctionnelle a été générée à partir d’une seule cellule souche dans un modèle de grossesse chez la souris [62]. Ceci soutient le rôle des cellules fœtales dans la production de lait. Fait intéressant, les femmes qui auraient une surproduction de lait pendant la lactation seraient plus susceptibles de développer un cancer du sein [52], alors que l’offre insuffisante de lait semble être sans rapport avec le cancer du sein [63]. L’ensemble de ces résultats suggère que les cellules fœtales microchimériques jouent un rôle dans la physiologie du sein et la production de lait, mais les effets sur la santé de la mère ne sont pas encore clairs.
Des cellules fœtales sont trouvées dans la thyroïde
La thyroïde est importante pour la thermorégulation et le métabolisme [64]. La production de chaleur est métaboliquement coûteuse tant pour la mère que pour le fœtus, ce qui induit que leurs intérêts ne sont pas toujours alignés. La progéniture bénéficie de la chaleur générée et transmise par la mère [65]. Des cellules fœtales dans la thyroïde maternelle pourraient améliorer la valeur sélective de la progéniture en manipulant la thermorégulation maternelle après la naissance. Ce qui prédit que la présence de cellules fœtales dans la thyroïde devrait être associée à une température plus élevée du corps maternel. La présence de cellules fœtales dans la thyroïde peut également contribuer au risque de cancer ou autres maladies de cet organe, si ces cellules se multiplient ou produisent des facteurs perturbant la physiologie thyroïdienne.
Alors que des cellules fœtales se trouvent dans les tissus de la thyroïde saine post-partum [66], les recherches actuelles suggèrent également leur association avec les maladies de la thyroïde. Des modèles murins de thyroïdite montrent une fréquence plus élevée de microchimérisme cellulaire fœtal dans la thyroïde pendant et après la grossesse [67]. Des cellules fœtales ont été trouvées plus fréquemment dans le sang et la thyroïde des femmes en cas de la thyroïdite de Hashimoto [44, 68-70], de maladie de Basedow [68-71], et de cancer [44, 66], par rapport à des témoins sains. Ces résultats suggèrent que la présence de cellules fœtales dans la thyroïde est plutôt défavorable à la santé de la mère.
Des cellules fœtales sont trouvées dans le cerveau
L’attachement maternel et le lien sont importants pour la santé de l'enfant [72]. Des hormones maternelles, telles que l'ocytocine et la prolactine sont libérées dans le cerveau et jouent des rôles importants pour la production de lait, les « montées de lait » ou contractions de l'allaitement [73], ainsi que pour la quiétude maternelle et l’intérêt porté à sa progéniture [74]. Notre cadre suggère que la sélection peut avoir favorisé des phénotypes microchimériques fœtaux aptes à manipuler le fonctionnement du cerveau de la mère pour améliorer le transfert de ressources et l'attachement à la progéniture.
Des microchimères ont été trouvées dans le cerveau des souris femelles, capables de s’intégrer aux circuits cérébraux et d’exprimer des marqueurs immunocytochimiques adaptés au cerveau [47]. De manière plus générale, le caractère totipotent des cellules fœtales [9, 37, 43] suggère qu'elles ont la capacité de se différencier en cellules qui pourraient participer au circuit neuronal et à la médiation chimique cérébrale, possibilités qui doivent être testées dans des recherches futures. Aujourd’hui, plusieurs études ont trouvé de l’ADN masculin dans le cerveau de femmes et de souris femelles [75, 47], mais l’éventuelle fonction de ces cellules est inconnue. Toutefois, une de ces études a trouvé de l’ADN mâle dans plusieurs régions du cerveau des femmes, et dans un cas, des décennies après que la femme ait donné naissance à un fils [75], ce qui suggère que le microchimérisme fœtal dans le cerveau maternel humain peut être généralisé et de longue durée.
Le rapport entre microchimérisme fœtal dans le cerveau et santé ou maladies maternelles n’est pas clair. Dans un modèle de maladie de Parkinson chez la souris, de L’ADN masculin a été détecté plus souvent chez les malades que chez les témoins sains [47]. Cependant, des cellules fœtales sont trouvées moins fréquemment dans les cerveaux de femmes atteintes de la maladie d'Alzheimer que chez des femmes indemnes de cette pathologie [75]. Ces conclusions suggèrent que cellules fœtales pourraient avoir des effets importants sur la fonction cérébrale, bien que les mécanismes sous-jacents soient encore inconnus.
Si la manipulation des cellules fœtales sur le cerveau des mères induit des niveaux
supérieurs de transmission des ressources à la progéniture, les contre-mesures maternelles pourraient consister en un ciblage immunitaire de ces cellules fœtales, ce qui pourrait augmenter les niveaux de l'inflammation dans le cerveau. Cela soulève le paradoxe d’une compétition entre cellules fœtales et cellules du système immunitaire maternel qui viendrait contrecarrer les effets escomptés ; ceci peut être une explication partielle de plusieurs résultats empiriques, dont l’association observée entre inflammation et dépression post-partum [76], ainsi que l’association de cette dépression avec une plus haute parité et un intervalle plus court entre les naissances [77], Cependant, il y a beaucoup d'autres explications possibles pour ces corrélations et de plus amples recherches sont nécessaires pour déterminer si le microchimérisme fœtal joue un rôle dans la santé émotionnelle maternelle. La possibilité que ce microchimérisme puisse jouer un rôle dans la santé mentale de la mère a d'ailleurs été suggéré [78], mais pas dans le cadre évolutionniste proposé ici.
Des cellules fœtales se trouvent sur les sites de maladies auto-immunes
La perspective d'une escalade du conflit entre les cellules fœtales et les tissus maternels, en particulier dans le contexte où l’immunité maternelle cible des cellules fœtales, peut contribuer à des maladies maternelles après la grossesse. Dans les situations où le conflit augmente, nous prévoyons une co-localisation des cellules fœtales et des cellules immunitaires maternelles, mais cette co-localisation peut aussi être le résultat d'une coopération comme pour la cicatrisation. Il est donc important de distinguer les prévisions et les effets pour chacun des rôles potentiels des cellules fœtales. Si les cellules fœtales améliorent la cicatrisation des plaies maternelles, la co-localisation des cellules immunitaires et des cellules fœtales serait tout simplement un sous-produit du fait que les deux peuvent être recrutées sur des sites de lésion. Une caractérisation des effets fonctionnels de cellules fœtales et immunitaires l’une sur l'autre et sur le tissu maternel serait de permettre de tester les hypothèses spécifiques qui découlent de l'hypothèse de l'escalade du conflit.
Des cellules fœtales ont été trouvées sur les sites inflammatoires et sont associées à de nombreuses maladies auto-immunes. Des cellules fœtales ont été trouvées plus fréquemment dans des échantillons tissulaires et sanguins chez des femmes atteintes de sclérose systémique [49, 79, 80], de syndrome de Sjögren [81], de lupus érythémateux disséminé (SLE) [82, 83], et de polyarthrite rhumatoïde (PR) [83, 84]. En outre, des cellules fœtales sont détectées au niveau des sites d'inflammation du corps maternel, dont les éruptions polymorphes de la grossesse (PEP) [85], les nodules rhumatoïdes de patients atteints de PR [86], et le goitre [68]. En revanche, quelques études ne trouvent aucune association entre les cellules fœtales et la sclérodermie [87, 88], le lupus [89], et le rhumatisme articulaire [90]. On ne sait pas si ces résultats sont dus à la migration de cellules fœtales sanguines dans les tissus malades ou si la présence de cellules fœtales contribue à la maladie. On ne sait pas non plus si la co-localisation de cellules fœtales et immunitaires contribue à la maladie auto-immune.
| Tableau 2 : Vue d'ensemble des effets du microchimérisme sur la santé et les maladies maternelles | |||
| Tissu | Maladie | Effet / Corrélation | Résultats des études |
| Cerveau | Maladie d'Alzheimer | Santé | Les microchimères sont moins fréquentes chez les malades que chez les sains [75] |
| Maladie de Parkinson | Maladie | Les microchimères sont plus fréquentes chez les malades (souris), mais pas à long terme [47] | |
| Seins | Cancer | Santé | Les microchimères sont moins fréquentes dans le sang et la glande mammaire des patientes atteintes [54-57] |
| Cancer | Santé | Les microchimères sont moins fréquentes dans les sous-types ER/PR positifs [53] | |
| Cancer | Maladie | Les microchimères sont plus fréquentes dans les sous-types HER-2 [53] | |
| Cancer | Maladie | Présence de dérivées des cellules fœtales dans le stroma tumoral [58] | |
| Cancer | Maladie | Les cellules fœtales sont présentes dans les carcinomes (souris) et plus fréquentes dans les cancers de haut grade [59] | |
| Thyroïde | Cancer | Santé | Cellules fœtales et ADN mâle trouvés plus souvent dans le sang chez les personnes saines. (Pas dans la thyroïde) [66] |
| Cancer | Maladie | Cellules fœtales trouvées plus souvent dans les tissus de la thyroïde malade [44-66] | |
| Thyroïdite de Hashimoto | Maladie | Microchimères et ADN mâle trouvés plus souvent dans le sang et la thyroïde des patients malades [44, 68-70, 113] | |
| Maladie de Graves/Basedow | Maladie | Microchimères et ADN mâle trouvés plus souvent dazns le dsang et la thyroïde des patients malades [69-71] | |
| Thyroïdites | Maladie | Cellules fœtales trouvées plus fréquemment dans la thyroïde des souris malades [67] | |
| Système immunitaire | Sclérose systémique | Maladie | Cellules fœtales et ADN mâle trouvées plus fréquemment dans le sang et la peau des malades [49,79,80] |
| Sclérose systémique | Pas d'association | Pas de différence de fréquence d'ADN mâle dans le sang entre patients et témoins sains [87, 88] | |
| Syndrome de Sjögren | Maladie | ADN mâle plus fréquent dans les glandes salivaires, mais pas dans le sang des malades [81] | |
| Lupus érythémateux | Maladie | ADN mâle et cellules foetales plus fréquents dans le sang des malades [82, 83] | |
| Lupus érythémateux | Maladie | ADN mâle et cellules foetales plus fréquents dans les tissus endommagés [114] | |
| Lupus érythémateux | Pas d'association | Pas de différence de fréquence dans le sang entre sains et malades [89] | |
| Polyarthrite rhumatoïde | Maladie | ADN mâle détecté dans les nodules rhumatoïdes [86] | |
| Polyarthrite rhumatoïde | Maladie | Cellules fœtales et ADN mâle plus fréquents dans le sang des malades [83, 84] | |
| Polyarthrite rhumatoïde | Pas d'association | Pas de différence de taux d'ADN mâle dans le sang entre malades et témoins [90] | |
| Poumons | Cancer | Maladie | Cellules fœtales plus fréquentes dans le thymus et les poumons des malades [92] |
| Cœur | Modèle de souris malade | Santé | Les cellules fœtales se différencient en cellules endothéliales, mus cle lisse et cardiomyocytes [48] |
| Cardiomyopathie | Maladie | Des cellules fœtales sont retrouvées dans le coaur des malades, mais pas des personnes saines [10] | |
| Foie, reins, rate | Modèle de souris malade | Santé | Des cellules fœtales vont vers les tissus malades [41, 42] |
| Tissus reproductifs | Cancer | Maladie | Les cellules fœtales sont plus fréquentes dans le col de l'utérus des malades [115] |
| Cancer | Pas d'association | L'ADN mâle a la même fréquence dans l'endomètre chez les malades et les témoins [116] | |
| Endométriose | Pas d'association | Pas d'ADN mâle dans l'endomètre, ni chez les malades ni ches les femmes saines [117] | |
| Colon | Cancer | Maladie | Les cellules fœtales sont plus fréquentes dans le sang des malades [56] |
| Peau | Cicatrice de césarienne | Santé | Les cellules fœtales sont présentes dans la cicatrice et expriment la cytokératine, le collagène I et III, et TGF β3 [16] |
| Modèle de souris malade | Santé | Les cellules fœtales sont plus fréquentes dans les tissus inflammatoires de la mère et elles participent à l'angiogenèse [17,40] | |
| Mélanome | Maladie | Les cellules fœtales sont plus fréquentes dans le mélanome que dans la peau saine. [118] | |
| Eruptions polymorphes de la grossesse | Maladie | L'ADN fœtal est détecté seulement dans la peau des femmes atteintes [85] | |
Des cellules fœtales sont également présentes dans des tissus maternels non associés à un conflit de ressources
Pendant la grossesse, les cellules fœtales pénètrent dans l'organisme de la mère par le placenta et voyagent dans les vaisseaux sanguins jusqu’à des organes où elles sont souvent retrouvées, tels que les poumons [8, 29], après avoir traversé la circulation pulmonaire de la mère [30, 91]. Bien que cette présence résulte de la physiologie de la circulation, ces cellules retrouvées dans les poumons sont parfois associées au cancer : une étude a révélé beaucoup plus de cellules fœtales dans le tissu pulmonaire et le thymus que dans la moelle osseuse, et plus d’ADN masculin dans les poumons malades que dans la moelle osseuse saine du même individu [92].
La grossesse est associée à des changements d’occurrence et de susceptibilité aux maladies auto-immunes
La grossesse est associée à l'apparition de certaines maladies auto-immunes et de cancers
L’entrée de cellules fœtales dans les tissus maternels pendant la grossesse, augmente probablement la sensibilité à certaines maladies auto-immunes et aux cancers. Beaucoup d’études ont trouvé une association de la grossesse avec des maladies du sein et de la thyroïde. Alors que la grossesse assure une protection contre le risque de cancer du sein à long terme, il y a un risque accru et transitoire du cancer du sein au cours des années qui suivent la grossesse [93], suggérant un rôle possible des cellules fœtales. Les maladies de la thyroïde sont communes pendant la grossesse, affectant 2 à 3% des femmes [94], et il y a une augmentation d’incidence de la thyroïdite de Hashimoto ou de la maladie de Graves post-partum [95]. Les femmes ont plus de risques de maladie auto-immune que les hommes [96] et le risque de telles maladies chez les femmes pares est significativement plus élevé après
la première année de post-partum [97]. Cependant, ces résultats sont incompatibles avec certaines études qui ne rapportent aucun lien entre parité et maladie auto-immune suivante [98]. Plusieurs complications de la grossesse sont associées à un taux plus élevé de cellules fœtales détectables dans le sang maternel, telles que la pré-éclampsie, le caryotype anormal et les fausses couches [19-22].
La grossesse modifie les symptômes des maladies auto-immunes
Peu d’études ont cherché à savoir si, pendant la grossesse, les cellules fœtales contribuent à la pathogenèse ou à l'amélioration des symptômes d’une maladie auto-immune déjà connue chez la mère. Pendant la gestation, le système immunitaire maternel développe une tolérance au fœtus, et cette tolérance est levée en post-partum [99]. La tolérance pour le fœtus peut aider à expliquer pourquoi des symptômes de maladie auto-immune sont parfois atténués pendant la grossesse. Par exemple, entre 43 et 75% des patientes atteintes de PR présentent une amélioration de tout ou partie de leurs symptômes au cours de la grossesse [100]. Plus encore, cette amélioration en cours de grossesse est suivie d’une exacerbation des symptômes en post-partum [100]. De même, en cas de sclérose en plaques, le taux de rechutes diminue avec la grossesse, avec le taux le plus bas au cours du troisième trimestre. En post-partum, le taux de rechutes revient à son niveau d’avant la grossesse [101]. Cependant, dans d'autres maladies auto-immunes, la grossesse ne produit aucun changement ou au contraire elle est associée à une exacerbation des symptômes [102, 103]. Notre cadre suggère que l'un des contributeurs à la maladie auto-immune pourrait être la réponse immunitaire maternelle à la présence et à l'action des cellules fœtales manipulant les tissus maternels. Étant donné que la tolérance maternelle au fœtus, donc aux cellules fœtales, est levée en post-partum, il est possible que la présence de grandes quantités de cellules fœtales (ou de cellules fœtales manipulant activement les tissus maternels) conduise à une intense réponse immunitaire maternelle, avec augmentation possible des symptômes de la maladie auto-immune. Les cellules fœtales pourraient être impliquées dans les modifications de la maladie auto-immune, ce qui devrait être pris en compte dans les futures études sur les interactions entre maladie auto-immune et grossesse.
Les recherches futures devraient utiliser des méthodes plus sensibles pour la détection des cellules fœtales et la détermination de leur fonction
Les principaux défis pour les travaux futurs sur le microchimérisme fœtal et la santé maternelle comprennent: (1) pouvoir distinguer les allèles fœtaux des allèles maternels; (2) la détection de très faibles niveaux de cellules fœtales; (3) l'identification du rôle fonctionnel des cellules fœtales dans les tissus maternels; et (4) la mesure des interactions entre les cellules fœtales et les cellules immunitaires maternelles. Les premières études sur le microchimérisme fœtal ont utilisé la présence ou de l'absence d’allèles liés au chromosome Y dans les échantillons de tissus maternels, notamment la présence de la région de détermination du sexe de l'Y (SRY). Une autre technique courante consiste à détecter la variation du nombre de motifs dans des répétitions en tandem (VNTR variable number of tandem repeats), chez les mères par rapport à leur progéniture, dans des loci de microsatellites (short tandem repeats) au sein du système HLA (A et B) [30], ou de détecter des différences dans des allèles HLA-DRB1 non partagés [104]. Les méthodes courantes pour distinguer les allèles fœtaux et maternels à un seul locus comprennent la cytométrie en flux, l’immunoprécipitation fluorescente du gène ou la PCR (polymerase chain reaction) classique ou quantitative [30, 105]. La PCR est plus précise que l’immunofluorescence pour détecter des cellules microchimériques [42], mais elle n’est pas aussi sensible que la cytométrie en flux. La PCR détecte les événements microchimériques à une fréquence d’environ 0,2% (198 cellules pour 105cellules hôtes), tandis que la cytométrie en flux peut détecter les microchimères à la fréquence de 0,05% (48 cellules pour 105) [105]. La détection d’allèles microchimériques de basse fréquence peut également souffrir de faux positifs dus à la contamination d’ADN étranger, comme cela est courant en clinique dans les équipements de laboratoire [106].
Pour augmenter la détection d’allèles fœtaux à chaque grossesse, le génotype de la mère et du père pourraient être utilisés pour développer de multiples loci sensibles de détection, soit en utilisant des dosages traditionnels soit la nouvelle génération de séquençage complet du génome. Cela peut aussi éviter la confusion d’un microchimérisme contemporain avec des événements microchimériques de grossesses précédentes. Tester plusieurs loci améliorera aussi la capacité de détecter des niveaux extrêmement bas de microchimérisme cellulaire fœtal. Un séquençage complet de faible couverture de l’ADN du plasma maternel est déjà utilisé pour des tests prénataux sensibles et non invasifs [107], et pourraient donc être utilisé pour détecter le microchimérisme pendant et après la grossesse. La détection devrait aussi inclure de multiples tissus. Bien que le sang soit le plus couramment utilisé et que l'ADN fœtal libre soit régulièrement détecté dans le sang maternel pendant la grossesse [107], le microchimérisme dans le sang disparaît après la grossesse [11], les événements microchimériques les plus pertinents cliniquement peuvent se trouver dans les tissus liés à la pathologie étudiée. La détection de cellules microchimériques est un obstacle, mais la détection seule ne suffit pas. Les études futures doivent également tenir compte de la fonction de ces cellules, peut-être par le tri à partir des tissus [108] et par l’analyse du transcriptome et du protéome. Plus que de comprendre la fonction, il serait important de comprendre comment ces cellules interagissent avec les tissus maternels. Par exemple, les premières études qui ont établi que des cellules d'origine fœtale (en particulier les trophoblastes extravilleux) modulent le système immunitaire maternel en interagissant avec les leucocytes maternels [109, 110], pourraient être reproduites dans le sein, la thyroïde ou le cerveau.
| Prédictions testables sur le microchimérisme | ||
| Prédictions | Raisonnement | Preuves |
| Les cellules microchimériques fœtales dans les seins augmentant la quantité et la qualité de lait | C'est l'intérêt de la progéniture d'augmenter la production de lait et sa qualité | contrôler le microchimérisme dans le sang et le lait et quantifier la production de lait à certains moments (par ex : 1, 2, 4 ou 10 semaines de post-partum |
| Le microchimérisme dans la thyroïde augmente la température du corps maternel | La progéniture aura probablement plus de ressources et le lien pourra être meilleur [65] | Quantifier les cellules fœtales dans le sang et mesurer la température maternelle avant la grossesse, puis chaque trimestre de grossesse, puis en post-partum |
| Les mécanismes du lien et de l'attachement sont augmentés par les cellules fœtales | La progéniture bénéficiera logiquement de plus de ressources [73] | Mesurer l'abondance de cellules fœtales circulantes et d'ocytocine en prepartum, au troisième trimestre puis tous les trois mois en post-partum |
| Les microchimères favorisent le développement et/ou la progression des cancers | Les cellules microchimériques ont quelques caractéristiques de cancer [119] dont la possibilité de se dissimuler à l'immunité maternelle [11] et de favoriser l'angiogenèse [40]. Ceci pourrait auglenter la vulnérabilité aux cancers en particulier aux stades initiaux. | Examiner la transcription de clones à l'intérieur de la tumeur en différents points en comparant les hommes et les nullipares aux femmes pares |
| Les cellules fœtales dans le système immunitaire augmentent la susceptibilité aux maladies auto-immunes | Il serait intéressant pour le fœtus d'échapper au système immunitaire maternel qui peut avoir des réponses variables selon les haplotypes HLA [7]. Une réponse exagérée de la mère aux cellules fœtales peut majorer la susceptibilité aux maladies auto-immunes ou les symptômes d'une telle maladie préexistante. Inversement une réponse plus réduite qu'attendu peut diminuer les symptômes d'une maladie auto-immune | Comparer des personnes ayant une maladie auto-immune ou une histoire familiale de telles maladies à des personnes sans susceptibilité, en mesurant l'abondance des cellules fœtales, les taux e CRP ou les cellules T régulatrices, pre-partum, chaque trimestre de grossesse et en post-partum. Conrôler le profil HLA, l'ADN libre, et déterminer les antigènes cellulaire feotaux exprimés. |
| La quantité de cellules fœtales dans e corps maternelles indique le début de grossesse, son évolution et sa terminaison | Les cellules fœtales jouent un rôle important dans la rétention du fœtus. La mère peut supprimer une réponse immune pour assurer le succès de la placentation et de la grossesse. Les cellules fœtales peuvent investir le thymus avant la placentation et la stimulation des cellules T régulatrices, se multiplier dans le sang jusqu'à l'accouchement [18,8]. ceci peut être impritant pour le déclenchemet du travail, même avant terme, soit par la réponse immunitaire maternelle, soit par un signal pour l'ocytocine. | Etudier une cohorte indemne de toute maladie et planifiant une grossesse, mesurer les cellules T régulatrices tous les 3 mois jusqu'à la grossesse, puis après tout en contrôlant les antigènes microchimériques dans le sang maternel à 6, 12, 20, 28,36, 40 semaines d'aménorrhée et 3 mois de post-partum. |
Conclusions et perspectives
Le microchimérisme est fréquent chez l'humain et a été trouvé chez les mammifères euthériens de tous types placentaires. Les cellules fœtales ont de nombreux parallèles avec le placenta et peuvent être considérées comme une extension de grande envergure du placenta « au-delà de l'utérus », dans les tissus maternels pendant la grossesse et longtemps après l'accouchement. Le cadre de coopération et de conflits que nous avons proposé peut aider à organiser et expliquer certains des résultats contradictoires de la littérature en ce qui concerne les effets des cellules fœtales sur la santé maternelle. Cependant, de nombreuses questions importantes subsistent. Un rôle éventuel des cellules fœtales, et de la réponse immunitaire de la mère, sur la santé ou les maladies maternelles n'a pas encore été définitivement montré. L’amélioration des méthodes pour distinguer les allèles maternels et fœtaux, la détection de faibles niveaux de microchimérisme dans le sang et les tissus maternels aideront à faire progresser notre compréhension du rôle du microchimérisme. Notre cadre fait de nombreuses prédictions (Fig. 2 et tableau 3) qui pourront être testées dans des travaux futurs, avec des implications potentiellement importantes pour notre compréhension de la santé, de la physiologie des maladies, dans des domaines aussi variés que la lactation, la pathologie thyroïdienne, les maladies auto-immunes, le cancer, ou encore les émotions maternelles et la santé psychologique du post-partum.
Traduction : Luc Perino
Bibliographie
Boddy AM, Fortunato A, Sayres MW, Aktipis A
Fetal microchimerism and maternal health: A review and evolutionary analysis of cooperation and conflict beyond the womb
BioEssays, Volume 37, Issue 10, pages 1106–1118, October 2015
DOI : 10.1002/bies.201500059
Références numérotées
1. Hamilton WD. 1964. The genetical evolution of social behaviour. II. J Theor Biol 7: 17–52.
2. Trivers RL. 1974. Parent-offspring conflict. Am Zool 14: 249–64.
3. Haig D. 1993. Genetic conflicts in human pregnancy. Q Rev Biol 68: 495–532.
4. Crespi B, Semeniuk C. 2004. Parent-offspring conflict in the evolution of vertebrate reproductive mode. Am Nat 163: 635–53.
5. Haig D. 2014. Interbirth intervals Intrafamilial, intragenomic and intrasomatic conflict. Evol Med Public Health 2014: 12–7.
6. Lo YM, Lau TK, Chan LY, Leung TN, et al. 2000. Quantitative analysis of the bidirectional fetomaternal transfer of nucleated cells and plasma DNA. Clin Chem 46: 1301–9.
7. Adams Waldorf KM, Gammill HS, Lucas J, Aydelotte TM, et al. 2010. Dynamic changes in fetal microchimerism in maternal peripheral blood mononuclear cells, CD4þ and CD8þ cells in normal pregnancy. Placenta 31: 589–94.
8. Fujiki Y, Johnson KL, Tighiouart H, Peter I, et al. 2008. Fetomaternal trafficking in the mouse increases as delivery approaches and is highest in the maternal lung. Biol Reprod 79: 841–8.
9. Bianchi DW, Zickwolf GK, Weil GJ, Sylvester S, et al. 1996. Male fetal progenitor cells persist in maternal blood for as long as 27 years postpartum. Proc Natl Acad Sci USA 93: 705–8.
10. Bayes-Genis A, Bellosillo B, de La Calle O, Salido M, et al. 2005. Identification of male cardiomyocytes of extracardiac origin in the hearts of women with male progeny: male fetal cell microchimerism of the heart. J Heart Lung Transplant 24: 2179–83.
11. Kolialexi A, Tsangaris GT, Antsaklis A, Mavroua A. 2004. Rapid clearance of fetal cells from maternal circulation after delivery. Ann NY Acad Sci 1022: 113–8.
12. StevensAM,HermesHM, KieferMM,RutledgeJC,et al.2009.Chimeric maternal cells with tissue-specific antigen expression and morphology are common in infant tissues. Pediatr Dev Pathol 12: 337–46.
13. Srivatsa B, Srivatsa S, Johnson KL, Bianchi DW. 2003. Maternal cell microchimerism in newborn tissues. J Pediatr 142: 31–5.
14. Bakkour S, Baker CA, Tarantal AF, Wen L, et al. 2014. Analysis of maternal microchimerism in rhesus monkeys (Macaca mulatta) using real-time quantitative PCR amplification of MHC polymorphisms. Chimerism 5: 6–15.
15. Guettier C, Sebagh M, Buard J, Feneux D, et al. 2005. Male cell microchimerism in normal and diseased female livers from fetal life to adulthood. Hepatol Baltim Md 42: 35–43.
16. Mahmood U, O’Donoghue K. 2014. Microchimeric fetal cells play a role in maternal wound healing after pregnancy. Chimerism 5: 40–52.
17. Nassar D, Droitcourt C, Mathieu-d’Argent E, Kim MJ, et al. 2012. Fetal progenitor cells naturally transferred through pregnancy participate in inflammation and angiogenesis during wound healing. FASEB J 26: 149–57.
18. Bianchi DW, Farina A, Weber W, Delli-Bovi LC, et al. 2001. Significant fetal-maternal hemorrhage after termination of pregnancy: implications
for development of fetal cell microchimerism. Am J Obstet Gynecol 184: 703–6.
19. Gammill HS, Aydelotte TM, Guthrie KA, Nkwopara EC, et al. 2013. Cellular fetal microchimerism in preeclampsia. Hypertension 62: 1062–7.
20. Gammill HS, Stephenson MD, Aydelotte TM, Nelson JL. 2014. Microchimerism in recurrent miscarriage. Cell Mol Immunol 11.6: 589–94.
21. Peterson SE, Nelson JL, Gadi VK, Gammill HS. 2013. Fetal cellular microchimerism in miscarriage and pregnancy termination. Chimerism 4: 136–8.
22. Lo YMD, Lau TK, Zhang J, Leung TN, et al. 1999. Increased fetal DNA concentrations in the plasma of pregnant women carrying fetuses with trisomy 21. Clin Chem 45: 1747–51.
23. Kallenbach LR, Johnson KL, Bianchi DW. 2011. Fetal cell microchimerism and cancer: a nexus of reproduction, immunology and tumor biology. Cancer Res 71: 8–12.
24. Pineda-Krch M, Lehtil€a K. 2004. Costs and benefits of genetic heterogeneity within organisms. J Evol Biol 17: 1167–77.
25. Wildman DE. 2011. Review: toward an integrated evolutionary understanding of the mammalian placenta. Placenta 32: S142–5.
26. Moffett A, Loke C. 2006. Immunology of placentation in eutherian mammals. Nat Rev Immunol 6: 584–94.
27. Axiak-Bechtel SM, Kumar SR, Hansen SA, Bryan JN. 2013. Ychromosome DNA is present in the blood of female dogs suggesting the presence of fetal microchimerism. PLoS One 8: e68114.
28. Turin L, Invernizzi P, Woodcock M, Grati FR, et al. 2007. Bovine fetal microchimerism in normal and embryo transfer pregnancies and its implications for biotechnology applications in cattle. Biotechnol J 2: 486–91.
29. Khosrotehrani K, Johnson KL, Gu_egan S, Stroh H, et al. 2005. Natural history of fetal cell microchimerism during and following murine pregnancy. J Reprod Immunol 66: 1–2.
30. Fugazzola L, Cirello V, Beck-Peccoz P. 2011. Fetal microchimerism as an explanation of disease. Nat Rev Endocrinol 7: 89–97.
31. Reiches MW, Ellison PT, Lipson SF, Sharrock KC, et al. 2009. Pooled energy budget and human life history. Am J Hum Biol 21: 421–9.
32. Hillard Kaplan S, Jane Lancaster. B. 2003. An evolutionary and ecological analysis of human fertility, mating patterns, and parental investment. In Wachter KW, Bulatao RA, ed; Offspring: Human Fertility Behavior in Biodemographic Perspective. Washington, DC: The National Academies Press, p. 170–223.
33. Geary DC, Flinn MV. 2001. Evolution of human parental behavior and the human family. Parenting 1: 5–61.
34. Bonney EA, Matzinger P. 1997. The maternal immune system’s interaction with circulating fetal cells. J Immunol Baltim Md 950 158:40–7.
35. Abrahams VM, Straszewski-Chavez SL, Guller S, Mor G. 2004. First trimester trophoblast cells secrete Fas ligand which induces immune
cell apoptosis. Mol Hum Reprod 10: 55–63.
36. Reik W, Walter J. 2001. Genomic imprinting: parental influence on the genome. Nat Rev Genet 2: 21–32.
37. O’Donoghue K, Chan J, de la Fuente J, Kennea N, et al. 2004. Microchimerism in female bone marrow and bone decades after fetal mesenchymal stem-cell trafficking in pregnancy. Lancet 364: 179–82.
38. Khosrotehrani K, Leduc M, Bachy V, Nguyen Huu S, et al. 2008. Pregnancy allows the transfer and differentiation of fetal lymphoid
progenitors into functional T and B cells in mothers. J Immunol Baltim Md 1950 180: 889–97.
39. Sharpless NE, DePinho RA. 2007. How stem cells age and why this makes us grow old. Nat Rev Mol Cell Biol 8: 703–13.
40. Nguyen Huu S, Oster M, Uzan S, Chareyre F, et al. 2007. Maternal neoangiogenesis during pregnancy partly derives from fetal endothelial progenitor cells. Proc Natl Acad Sci USA 104: 1871–6.
41. Wang Y, Iwatani H, Ito T, Horimoto N, et al. 2004. Fetal cells in mother rats contribute to the remodeling of liver and kidney after injury. Biochem Biophys Res Commun 325: 961–7.
42. Khosrotehrani K, Reyes RR, Johnson KL, Freeman RB, et al. 2007. Fetal cells participate over time in the response to specific types of murine maternal hepatic injury. Hum Reprod Oxf Engl 22: 654–61.
43. Khosrotehrani K, Johnson KL, Cha D, Salomon RN, et al. 2004. Transfer of fetal cells with multilineage potential to maternal tissue. JAMA 292: 75–80.
44. Srivatsa B, Srivatsa S, Johnson KL, Samura O, et al. 2001. Microchimerism of presumed fetal origin in thyroid specimens from women: a case-control study. Lancet 358: 2034–8.
45. Nelson JL. 2012. The otherness of self: microchimerism in health and disease. Trends Immunol 33: 421–7.
46. Tan X-W, Liao H, Sun L, OkabeM, et al. 2005. Fetal microchimerism in the maternal mouse brain: a novel population of fetal progenitor or stem cells able to cross the blood-brain barrier? Stem Cells Dayt Ohio 23: 1443–52.
47. Zeng XX, Tan KH, Yeo A, Sasajala P, et al. 2010. Pregnancyassociated progenitor cells differentiate and mature into neurons in the maternal brain. Stem Cells Dev 19: 1819–30.
48. Kara RJ, Bolli P, Karakikes I, Matsunaga I, et al. 2011. Fetal cells traffic to injured maternal myocardium and undergo cardiac differentiation.
Circ Res 111: 249037.
49. Evans PC, Lambert N, Maloney S, Furst DE, et al. 1999. Long-term fetal microchimerism in peripheral blood mononuclear cell subsets in healthy women and women with scleroderma. Blood 93: 2033–7.
50. Hinde K, Skibiel AL, Foster AB, Rosso LD, et al. 2015. Cortisol in mother’s milk across lactation reflects maternal life history and predicts
infant temperament. Behav Ecol 26: 269–81.
51. Zhou L, Yoshimura Y, Huang Y, Suzuki R, et al. 2000. Two independent pathways of maternal cell transmission to offspring: through placenta during pregnancy and by breast-feeding after birth. Immunology 101: 570–80.
52. Gustb_ee E, Anesten C, Markkula A, Simonsson M, et al. 2013. Excessive milk production during breast-feeding prior to breast cancer diagnosis is associated with increased risk for early events. SpringerPlus 2: 298.
53. Dhimolea E, Denes V, Lakk M, Al-Bazzaz S, et al. 2013. High male chimerism in the female breast shows quantitative links with cancer. Int J Cancer 133: 835–42.
54. Gadi VK, Nelson JL. 2007. Fetal microchimerism in women with breast cancer. Cancer Res . 67: 9035–8.
55. Gadi VK, Malone KE, Guthrie KA, Porter PL, et al. 2008. Case-control study of fetal microchimerism and breast cancer. PLoS One 3: e1706.
56. Kamper-Jørgensen M, Biggar RJ, Tjønneland A, Hjalgrim H, et al. 2012. Opposite effects of microchimerism on breast and colon cancer. Eur J Cancer Oxf Engl 1990 48: 2227–35.
57. Eun JK, Guthrie KA, Zirpoli G, Gadi VK. 2013. In situ breast cancer and microchimerism. Sci Rep 3: 2192.
58. Dubernard G, Aractingi S, Oster M, Rouzier R, et al. 2008. Breast cancer stroma frequently recruits fetal derived cells during pregnancy.
Breast Cancer Res 10: R14.
59. Dubernard G, Oster M, Chareyre F, Antoine M, et al. 2009. Increased fetal cell microchimerism in high grade breast carcinomas occurring
during pregnancy. Int J Cancer 124: 1054–9.
60. Hassiotou F, Beltran A, Chetwynd E, Stuebe AM, et al. 2012. Breastmilk is a novel source of stem cells with multilineage differentiation
potential. Stem Cells Dayt Ohio 30: 2164–74.
61. Wang S, Zhang J, Geng Y, Zhu S. 2003. Plasticity of the response of fetal mouse fibroblast to lactation hormones. Cell Biol Int 27: 755–60.
62. Shackleton M, Vaillant F, Simpson KJ, Stingl J, et al. 2006. Generation of a functional mammary gland from a single stem cell. Nature 439: 84–8.
63. Cohen JM, Hutcheon JA, Julien SG, Tremblay ML, et al. 2009. Insufficient milk supply and breast cancer risk: a systematic review. PLoS One 4: e8237.
64. Arthur JR, Beckett GJ. 1999. Thyroid function. Br Med Bull 55: 658–68. 65. Winberg J. 2005. Mother and newborn baby: mutual regulation of physiology and behavior-a selective review. Dev Psychobiol 47: 217–29.
66. Cirello V, Recalcati MP, Muzza M, Rossi S, et al. 2008. Fetal cell microchimerism in papillary thyroid cancer: a possible role in tumor damage and tissue repair. Cancer Res 68: 8482–8.
67. Imaizumi M, Pritsker A, Unger P, Davies TF. 2002. Intrathyroidal fetal microchimerism in pregnancy and postpartum. Endocrinology 143: 247–53.
68. Klintschar M, Immel U-D, Kehlen A, Schwaiger P, et al. 2006. Fetal microchimerism in Hashimoto’s thyroiditis: a quantitative approach. Eur
J Endocrinol 154: 237–41.
69. Lepez T, Vandewoestyne M, Hussain S, Van Nieuwerburgh F, et al. 2011. Fetal microchimeric cells in blood of women with an autoimmune
thyroid disease. PLoS One 6: e29646.
70. Renn_e C, Ramos Lopez E, Steimle-Grauer SA, Ziolkowski P, et al. 2004. Thyroid fetal male microchimerisms in mothers with thyroid disorders: presence of Y-chromosomal immunofluorescence in thyroid infiltrating lymphocytes is more prevalent in Hashimoto’s thyroiditis and Graves’ disease than in follicular adenomas. J Clin Endocrinol Metab 89: 5810–4.
71. Ando T, Imaizumi M, Graves PN, Unger P, et al. 2002. Intrathyroidal fetal microchimerism in Graves’ disease. J Clin Endocrinol Metab 87: 3315–20.
72. Benoit D. 2004. Infant-parent attachment: definition, types, antecedents, measurement and outcome. Paediatr Child Health 9: 541–5.
73. Carter CS. 2014. Oxytocin pathways and the evolution of human behavior. Annu Rev Psychol 65: 17–39.
74. Keverne EB. 2014. Significance of epigenetics for understanding brain development, brain evolution and behaviour. Neuroscience 264: 207– 17.
75. Chan WFN, Gurnot C, Montine TJ, Sonnen JA, et al. 2012. Male microchimerism in the human female brain. PLoS One 7: e45592.
76. Kendall-Tackett K. 2007. A new paradigm for depression in new mothers: the central role of inflammation and how breastfeeding and anti-inflammatory treatments protect maternal mental health. Int Breastfeed J 2: 6.
77. G€urel a S, G€urel H. 2000. The evaluation of determinants of early postpartum low mood: the importance of parity and inter-pregnancy interval. Eur J Obstet Gynecol Reprod Biol 91: 21–4.
78. Demirbek B, Yurt E. 2011. Can microchimerism find itself a place in psychiatric research? Psikiyatr Guncel Yaklasimlar Curr Approache Psychia 3: 296–308.
79. Artlett CM, Smith JB, Jimenez SA. 1998. Identification of fetal DNA and cells in skin lesions from women with systemic sclerosis. N Engl J Med 338: 1186–91.
80. Lambert NC, Lo YMD, Erickson TD, Tylee TS, et al. 2002. Male microchimerism in healthy women and women with scleroderma: cells or circulating DNA? A quantitative answer. Blood 100: 2845–51.
81. Endo Y, Negishi I, Ishikawa O. 2002. Possible contribution of microchimerism to the pathogenesis of Sj€ogren’s syndrome. Rheumatology 41: 490–5.
82. Abbud Filho M, Pavarino-Bertelli EC, Alvarenga MPS, Fernandes IMM, et al. 2002. Systemic lupus erythematosus and microchimerism in autoimmunity. Transplant Proc 34: 2951–2.
83. Kekow M, Barleben M, Drynda S, Jakubiczka S, et al. 2013. Long term persistence and effects of fetal microchimerisms on disease onset and status in a cohort of women with rheumatoid arthritis and systemic lupus erythematosus. BMC Musculoskelet Disord 14: 325.
84. Rak JM, Maestroni L, Balandraud N, Guis S, et al. 2009. Transfer of the shared epitope through microchimerism in women with rheumatoid arthritis. Arthritis Rheum 60: 73–80.
85. Aractingi S, Berkane N, Bertheau P, Le Gou_eC, et al. 1998. Fetal DNA in skin of polymorphic eruptions of pregnancy. Lancet 352: 1898–901.
86. Chan WFN, Atkins CJ, Naysmith D, van der Westhuizen N, et al. 2012. Microchimerism in the rheumatoid nodules of patients with rheumatoid arthritis. Arthritis Rheum 64: 380–8.
87. Selva-O’Callaghan A, Mijares-Boeckh-Behrens T, Prades EB, Solans-Laqu_eR, et al. 2003. Lack of evidence of foetal microchimerism in female Spanish patients with systemic sclerosis. Lupus 12: 15–20.
88. Murata H, Nakauchi H, Sumida T. 1999. Microchimerism in Japanese women patients with systemic sclerosis. Lancet 354: 220.
89. Mosca M, Curcio M, Lapi S, Valentini G, et al. 2003. Correlations of Y chromosome microchimerism with disease activity in patients with SLE: analysis of preliminary data. Ann Rheum Dis 62: 651–4.
90. Yan Z, Lambert NC, Guthrie KA, Porter AJ, et al. 2005. Male microchimerism in women without sons: quantitative assessment and correlation with pregnancy history. Am J Med 118: 899–906.
91. Pritchard S, Hoffman AM, Johnson KL, Bianchi DW. 2011. Pregnancy-associated progenitor cells: an under-recognized potential source of stem cells in maternal lung. Placenta 32: S298–303.
92. O’Donoghue K, Sultan HA, Al-Allaf FA, Anderson JR, et al. 2008. Microchimeric fetal cells cluster at sites of tissue injury in lung decades
after pregnancy. Reprod Biomed Online 16: 382–90.
93. Lambe M, Hsieh C, Trichopoulos D, Ekbom A, et al. 1994. Transient increase in the risk of breast cancer after giving birth. N Engl J Med 331: 5–9.
94. Negro R, Mestman JH. 2011. Thyroid disease in pregnancy. Best Pract Res Clin Endocrinol Metab 25: 927–43.
95. Weetman AP. 2010. Immunity, thyroid function and pregnancy: molecular mechanisms. Nat Rev Endocrinol 6: 311–8.
96. Gleicher N, Barad DH. 2007. Gender as risk factor for autoimmune diseases. J Autoimmun 28: 1–6.
97. Khashan AS, Kenny LC, Laursen TM, Mahmood U, et al. 2011. Pregnancy and the risk of autoimmune disease. PLoS One 6: e19658.
98. Sgarbi JA, Kasamatsu TS, Matsumura LK, Maciel RMB. 2010. Parity is not related to autoimmune thyroid disease in a population-based study of Japanese-Brazilians. Thyroid 20: 1151–6.
99. Veenstra van Nieuwenhoven AL, Heineman MJ, FaasMM. 2003. The immunology of successful pregnancy. Hum Reprod Update 9: 347–57.
100. Hazes JMW, Coulie PG, Geenen V, Vermeire S, et al. 2011. Rheumatoid arthritis and pregnancy: evolution of disease activity and pathophysiological considerations for drug use. Rheumatology 50: 1955–68.
101. Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniaire P, et al. 1998. Rate of pregnancy-related relapse in multiple sclerosis. N Engl J Med 339: 285–91.
102. Petri M, Howard D, Repke J. 1991. Frequency of lupus flare in pregnancy. The Hopkins Lupus Pregnancy Center experience. Arthritis Rheum 34: 1538–45.
103. Ruiz-Irastorza G, Lima F, Alves J, Khamashta MA, et al. 1996. Increased rate of lupus flare during pregnancy and the puerperium: a prospective study of 78 pregnancies. Br J Rheumatol 35: 133–8.
104. Pujal J-M, Gallardo D. 2008. PCR-based methodology for molecular microchimerism detection and quantification. Exp Biol Med Maywood NJ 233: 1161–70.
105. Thiele K, Holzmann C, Solano ME, Zahner G, et al. 2014. Comparative sensitivity analyses of quantitative polymerase chain reaction and flow cytometry in detecting cellular microchimerism in murine tissues. J Immunol Methods 406: 74–82.
106. Reed W, Lee TH, Vichinsky EP, Lubin BH, et al. 1998. Sample suitability for the detection of minor white cell populations (microchimerism) by polymerase chain reaction. Transfusion 38: 1041–5.
107. Lau TK, Cheung SW, Lo PSS, Pursley AN, et al. 2014. Non-invasive prenatal testing for fetal chromosomal abnormalities by low-coverage whole-genome sequencing of maternal plasma DNA: review of consecutive cases in a single center. Ultrasound Obstet Gynecol 43: 254–64.
108. Pritchard S, Wick HC, Slonim DK, Johnson KL, et al. 2012. Comprehensive analysis of genes expressed by rare microchimeric fetal cells in the maternal mouse lung. Biol Reprod 87: 42.
109. Gregori S, Amodio G, Quattrone F, Panina-Bordignon P. 2015. HLAG orchestrates the early interaction of human trophoblasts with the maternal niche. Front Immunol 6: 128.
110. Tilburgs T, Crespo ^AC, van der Zwan A, Rybalov B, et al. 2015. Human HLA-Gþ extravillous trophoblasts: immune-activating cells that interact with decidual leukocytes. Proc Natl Acad Sci USA 112: 7219–24.
111. Sunami R, Komuro M, Tagaya H, Hirata S. 2010. Migration of microchimeric fetal cells into maternal circulation before placenta formation. Chimerism 1: 66–8.
112. Bininda-Emonds ORP, Cardillo M, Jones KE, MacPhee RDE, et al. 2007. The delayed rise of present-day mammals. Nature 446: 507–12.
113. Klintschar M, Schwaiger P, Mannweiler S, Regauer S, et al. 2001. Evidence of fetal microchimerism in Hashimoto’s thyroiditis. J Clin Endocrinol Metab 86: 2494–8.
114. Johnson KL, McAlindon TE, Mulcahy E, Bianchi DW. 2001. Microchimerism in a female patient with systemic lupus erythematosus. Arthritis Rheum 44: 2107–11.
115. Cha D, Khosrotehrani K, Kim Y, Stroh H, et al. 2003. Cervical cancer and microchimerism. Obstet Gynecol 102: 774–81.
116. Hromadnikova I, Kotlabova K, Pirkova P, Libalova P, et al. 2014. The occurrence of fetal microchimeric cells in endometrial tissues is a very common phenomenon in benign uterine disorders, and the lower prevalence of fetal microchimerism is associated with better uterine cancer prognoses. DNA Cell Biol 33: 40–8.
117. Fassbender A, Debiec-Rychter M, Bree RV, Vermeesch JR, et al. 2015. Lack of evidence that male fetal microchimerism is present in endometriosis. Reprod Sci 1933719115574343.
118. Nguyen Huu S, Oster M, Avril M-F, Boitier F, et al. 2009. Fetal microchimeric cells participate in tumour angiogenesis in melanomas occurring during pregnancy. Am J Pathol 174: 630–7.
119. Hanahan D, Weinberg RA. 2000. The hallmarks of cancer. Cell 100: 57–70.
Et pour aller plus loin
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Transplantation de microbiote fécal contre les infections urinaires - La transplantation de microbiote fécal limite la résistance aux antibiotiques, y compris pour les [...]
Pourquoi le canal génital humain est tordu ? - Pourquoi les humains possèdent-ils un canal génital tordu ? Le canal de naissance humain [...]
Le microbiote manipule l'appétit - Les microbes dans le tractus gastro-intestinal sont sous pression sélective pour manipuler le [...]
La barbe : sélection intrasexuelle ou intersexuelle - La sélection naturelle, selon laquelle les caractéristiques environnementales favorisent des [...]
Chromosomes sexuels et longévité - Le sexe avec le chromosome sexuel réduit meurt plus tôt : une comparaison à travers l'arbre de [...]
Vous aimerez aussi ces humeurs...
Bref essai de talibanologie - Les Talibans viennent d’interdire aux filles l’accès à l’université. Une brimade de [...]
Supplique contre le masque à l’école - Intuitivement, le masque est utile en cas d’épidémie de virose respiratoire. Confirmer [...]
Maladie à tous les étages - La précarité sociale est devenue le principal facteur de risque de maladies, diminuant [...]
Médias et médecine - Les grands médias ont toujours salué avec assiduité les progrès médicaux. Les succès [...]
Mots et lieux de l'hystérie - Les noms des maladies ont varié au gré des connaissances. Mais plus souvent, c’est [...]
La phrase biomédicale aléatoire
Les soignants trimballent des corps mous pour aller les poser à l'endroit indiqué par le programme, ou les remettre dans une position acceptable pour la famille dont la visite est attendue.
L'unité de temps d'une maison de retraite est la durée entre deux positions d'un corps.
― Luc Perino