L'auto-immunité et le sexe
dernière mise à jour le 24/11/2022
L’auto-immunité est-elle un problème de sexe ?
Abstract
Les maladies auto-immunes comprennent plusieurs affections dont on estime qu'elles affectent cumulativement plus de 5% de la population américaine avec une prédominance féminine frappante signalée pour la plupart d'entre elles. La cause et les mécanismes de ce biais sexuel restent inconnus malgré les multiples hypothèses proposées. En effet, il est bien établi dans plusieurs contextes expérimentaux que chez l'humain, le système immunitaire présente un dimorphisme sexuel avec des réponses immunitaires de base différentes entre hommes et femmes. Parmi les facteurs candidats pour expliquer ces différences, nous notons qu’une attention particulière a été consacrée aux hormones sexuelles, mais des données n’ont pas été concluantes ou n'ont pas été confirmées. La même chose semble s'appliquer à l'hypothèse du microchimérisme. Plus récemment, des anomalies des chromosomes sexuels et l’inactivation d’un chromosome X asymétrique ont été suggérées comme de nouveaux acteurs, en particulier dans les maladies d'apparition tardive. Nous passons en revue ici les données les plus récentes sur les mécanismes proposés pour la prédominance féminine.
Nous essayons également de déterminer si les sex-ratios observés peuvent résulter aussi d’un biais de sensibilisation au sexe dans les études de cas.
Introduction
Les maladies auto-immunes (MAI) comprennent plus de 70 maladies différentes affectant plus de 10 millions de patients aux États-Unis.
Ces troubles manifestent une grande variabilité en termes de tissus cibles, d’âge d'apparition et de réponse aux traitements immunosuppresseurs. La seule caractéristique partagée par la majorité d’entre eux, est la prédominance chez les femmes ; plus de 80% des patients atteints de MAI étant des femmes.
Même si la prédisposition féminine aux MAI est connue depuis plus d'un siècle, les causes précises de cette différence demeurent inconnues et relativement peu d'hypothèses ont été proposées. Une prédisposition génétique semble être nécessaire, mais pas suffisante, pour expliquer à la fois l'apparition des MAI et la prédominance féminine, car plusieurs facteurs environnementaux jouent un rôle dans ces ruptures de la tolérance immunitaire
Parmi les facteurs liés au sexe qui ont été proposés, notons que ce sont les hormones, l’histoire de la reproduction (grossesses à terme ou non), le microchimérisme fœtal, l’inactivation du chromosome X et les anomalies de ce chromosome qui ont recueilli le plus de données. Cependant, aucune de ces hypothèses n'a jusqu'à présent recueilli suffisamment de preuves convaincantes et, dans la plupart des cas, les données sont contradictoires. Parmi les effets des hormones sexuelles sur la fonction immunitaire on a d'abord constaté le rôle des œstrogènes dans la maturation lymphocytaire, l’activation et synthèse d'anticorps et de cytokines. De plus, en comparant des réponses immunitaires chez des sujets normaux et atteints de MAI, on a constaté que les ligands aux récepteurs d’œstrogènes sont capables de moduler à la fois les composants de l’immunité innée et acquise, ils modifient le nombre et la fonction des cellules présentatrices d’antigènes in vivo et in vitro, et ils régulent la différenciation des cellules dendritiques. Lorsque ces observations ont été utilisées pour comparer les profils hormonaux sexuels entre patients atteints de MAI et témoins, les résultats ont été décevants. En outre, l'apparition de MAI chez les mâles, leur début à différents moments de l'histoire de la reproduction chez les femmes et l’absence d’effet consistant sur le cours des maladies, n’est pas en faveur du rôle des hormones sexuelles.
Les chromosomes sexuels ont ensuite été largement étudiés, ainsi que le rôle du microchimérisme fœtal et de l'inactivation du chromosome X, mais attendent confirmation. Une inactivation de chromosome X sévèrement asymétrique a été trouvée chez les femmes atteintes de sclérodermie.
Nous avons ensuite démontré que les femmes atteintes de cirrhose biliaire primitive, de sclérodermie et de maladies auto-immunes thyroïdiennes présentent un taux accru de cellules monosomiques X dans les cellules du sang périphérique par rapport aux femmes en bonne santé du même âge.
Cette revue propose d’illustrer les preuves disponibles et les théories proposées sur les différences entre les sexes dans les MAI et d’en discuter les implications et limites. Le tableau 1 illustre les principaux mécanismes pouvant expliquer la prédominance féminine des MAI.
- Différences entre les sexes et système immunitaire
Le système immunitaire humain manifeste un certain degré de dimorphisme sexuel avec des réponses immunitaires de base différentes entre femmes et hommes. De manière générale, les femmes ont une meilleure production d'anticorps et une meilleure réponse immunité à médiation cellulaire la vaccination, alors que les hommes ont une réponse inflammatoire plus intense aux organismes pathogènes. De plus, les femmes ont un nombre de lymphocytes T CD4+ plus élevé que les hommes ce qui contribue à une augmentation du rapport CD4/CD8. Elles ont des taux plasmatiques d'IgM plus élevés et une plus grande production de cytokines Th1. L'importance de ces dissemblances reste à mieux définir, puisqu’à l'exception évidente des MAI, il n'y a pas de grosses différences dans la sensibilité aux infections ou dans les degrés d'inflammation entre les sexes.
- Sex-ratios des maladies auto-immunes
Les différences sexuelles les plus frappantes dans les maladies auto-immunes sont observés dans le syndrome de Sjogren, le lupus érythémateux systémique, la cirrhose biliaire primitive, les maladies thyroïdiennes auto-immunes et la sclérodermie pour lesquelles 80% des patients sont des femmes. Pour la polyarthrite rhumatoïde, la sclérose en plaques et la myasthénie, la prédominance féminine est de 60 à 75%.
Un troisième groupe, qui comprend les maladies inflammatoires de l'intestin et le diabète à médiation immunitaire (diabète de type 1), se caractérise par un ratio femmes/hommes qui se rapproche de 1:1 avec une légère prédominance du sexe masculin. Enfin, il semble que certains troubles auto-immuns tels que la cholangite sclérosante primitive se caractérisent par une prédominance masculine.
- Hormones sexuelles
Les œstrogènes, les androgènes et la prolactine ont été les premiers candidats proposés pour jouer un rôle important dans le dimorphisme sexuel de l'auto-immunité, en raison de leur capacité à moduler la réponse immunitaire via les récepteurs aux androgènes et aux œstrogènes.
En effet, les progéniteurs et les cellules matures expriment tous deux les récepteurs et suggèrent que les hormones sexuelles peuvent directement moduler le développement des cellules immunitaires. Les hormones sexuelles peuvent également influencer directement le guidage des lymphocytes à un organe cible et le processus de présentation de l'antigène, influençant ainsi la spécificité organique de la MAI et la dégradation de la tolérance immunitaire. Plus précisément, la production d'IFN-γ, d'IL-1 et d'IL-10 est améliorée in vitro par les œstrogènes tandis que l'IL-4 et l'IL-5 diminuent en présence d'androgènes. Ces différences peuvent déterminer des environnements immunitaires distincts entre hommes et femmes, ces dernières étant plus susceptibles de développer une réponse de type Th1, sauf pendant la grossesse où la réponse Th2 est prédominante.
L'effet modulateur des œstrogènes est différent de la norme lors des MAI, avec un effet biphasique. En effet, des niveaux inférieurs facilitent la réponse immunitaire tandis que des niveaux plus élevés la suppriment. Il a été démontré, par exemple, que la sécrétion d'IFN-γ est généralement stimulée par les œstrogènes mais le pic est plus haut à des concentrations d'œstrogènes plus faibles. L'effet des œstrogènes sur la sécrétion de TNF-αβ est également biphasique, avec une amélioration lors de faibles concentrations et une inhibition à fortes concentrations. Ces données indiquent que les œstrogènes sont capables de moduler à la fois les activités pro- et anti-inflammatoire des lymphocytes T CD4+ et ont donc le potentiel d’influencer la réactivité de la réponse immunitaire médiée par les lymphocytes T CD4+. Les hormones sexuelles modulent également l'axe hypothalamo-hypophyso-surrénalien (HHS) et sont donc capables de moduler la réponse au stress. En effet, les femmes ont une concentration plus élevée de corticostérone-cortisol par rapport aux hommes et les glucocorticoïdes suppriment la production d’hormones sexuelles ainsi que leur action dans les tissus.
Ces mécanismes sont au cœur de la régulation de l'équilibre Th1/Th2 dans les sites inflammatoires, de l'arrêt approprié ou non de la réponse inflammatoire aux infections et du développement de la tolérance immunitaire ou des MAI.
Lorsque des MAI spécifiques ont été étudiés, des taux plasmatiques accrus d’œstrogènes ont été signalés chez des patients atteints de lupus érythémateux diffus, alors que l’incidence élevée de la maladie au cours de la période de reproduction de la femme et la fréquence des poussées pendant la grossesse sont en faveur d’un rôle des hormones sexuelles. Étant donné que le lupus est caractérisé par une augmentation de la réponse Th2, ces observations où les œstrogènes stimulent les sécrétions d'IL-4, IL-5, IL-6 et d'IL-10 par les lymphocytes Th2 ont un intérêt évident. Ces cytokines sont également de puissants stimulateurs de la maturation des lymphocytes B et favorisent la survie et l'activation des cellules B autoréactives de haute affinité. De façon intéressante, les œstrogènes et la prolactine en eux-mêmes, partagent le la capacité de briser la tolérance et conduisent à l'apparition de lymphocytes B réactifs à l'ADN. L'administration d'estradiol à des modèles animaux de lupus augmente la production totale d'IgG, induit la sécrétion d’anticorps anti-ADN spécifiques et accélère l'apparition de glomérulonéphrite complexe. Dans le même scénario, les femmes ovariectomisées ont de meilleurs taux de survie. Comme pour le taux d’œstrogènes, une hyperprolactinémie a été observée chez 25 % des patients atteints de lupus. Une corrélation entre l’apoptose et les MAI est déjà bien admise, possiblement en raison d’une élimination inefficace des cellules apoptotiques. Les œstrogènes et la prolactine peuvent toutes deux réguler la survie des cellules immunitaires par le système Fas/FasL qui s’exprime en FasL dans les monocytes. Mais si ces deux hormones jouent un rôle direct, il reste à déterminer.
Plusieurs études ont tenté de déterminer l'impact des hormones sexuelles sur la cirrhose biliaire primitive. La corrélation négative avec le nombre de grossesses a d’abord été niée par les études épidémiologiques puis finalement confirmée. Plus intéressant, les traitements hormonaux substitutifs de la ménopause sont significativement associés à une augmentation des cirrhoses biliaires primitives. De plus, lors d’études antérieures, les différences de taux plasmatiques d'œstrogènes entre les femmes atteintes et les témoins pouvaient être secondaires à une cholestase de longue date ou simplement expliquer la grande variabilité de leurs mesures pendant le cycle de reproduction.
- Microchimérisme fœtal dans l'auto-immunité
Il a été suggéré dans la pathogenèse des MAI, que la prédominance féminine peut être secondaire à la présence chez les femmes de cellules fœtales mâles allogéniques des décennies après la grossesse (c'est le microchimérisme fœtal). Des cellules microchimériques ont été trouvées pour la première fois dans les cellules mononucléaires du sang périphérique de patientes atteints de sclérodermie et il a été suggéré que ces cellules non autologues peuvent conduire à une réaction pathologique de type « réaction du greffon contre l'hôte ». D’autres études n'ont pas réussi à le confirmer. Plusieurs études n'ont pas trouvé de différence significative de fréquence du microchimérisme masculin entre les femmes atteintes de cirrhose et les témoins. Au total, les données disponibles sur le rôle du microchimérisme fœtal dans les MAI sont encore controversées, d’autant que le microchimérisme fœtal et maternel est sont fréquents chez les individus sains.
- La génétique des chromosomes sexuels
L'importance des facteurs génétiques en tant que possibles déterminants de la susceptibilité aux MAI est étayée par des regroupements classiques : prévalence variable selon les groupes ethniques, associations avec des haplotypes HLA, polymorphisme d’un seul nucléotide (SNIP) et taux concordants entre jumeaux monozygotes et dizygotes. De manière assez surprenante, cependant, peu d'études ont étudié la génétique des chromosomes sexuels dans les MAI, malgré des indices majeurs comme l'observation que plusieurs gènes cruciaux pour le maintien de la fonction immunitaire et de la tolérance sont situés sur le chromosome X. En fait, des mutations spécifiques de gènes du chromosome X provoquent des syndromes d'immunodéficience de sévérité variable. Foxp3, situé sur le bras court du chromosome X, est essentiel pour les cellules T régulatrices et sa déficience ou ses mutations entraînent une maladies auto-immune multiviscérale d’apparition précoce, très agressive et souvent mortelle. De plus, la monosomie constitutive de X ou ses graves anomalies structurelles dans le syndrome de Turner s’accompagnent de troubles auto-immuns et, dans certains cas, de cholestase chronique.
L'héritage du chromosome X présente une particularité par rapport aux autosomes, puisque les femmes sont des mosaïques fonctionnelles pour les gènes liés à l'X. Chez la femme, la plupart des gènes sur un chromosome X sont réduits au silence par inactivation, bien que des données plus récentes démontrent que plusieurs gènes peuvent échapper à l’inactivation du chromosome X dans des conditions physiologiques. Le résultat de ce processus conduit à des niveaux équivalents de gènes lié à l'X entre hommes et femmes. Comme mentionné ci-dessus, cependant, au moins 15% des gènes liés à l'X sont capables d’échapper à l’inactivation chez les femmes en bonne santé et sont exprimés par les deux chromosomes de la paire. Parmi ceux-ci, jusqu'à 10% du total des gènes liés à l'X ont des inactivations variables selon les individus.
À la suite de ces observations, un rôle du chromosome X dans les MAI a été proposé pour la première fois en se basant sur le fait que les femmes atteintes de MAI ont une fréquence significativement plus élevée de cellules sanguines périphériques avec un seul chromosome X (monosomie) par rapport aux femmes en bonne santé. Cela a surtout été observé dans la sclérodermie, les maladies thyroïdiennes auto-immunes ou la cirrhose biliaire primitive. La découverte ultérieure que le chromosome X perdu est préférentiellement un chromosome d’héritage parental soutient également l’implication critique des gènes du chromosome X dans la prédisposition féminine aux MAI. D'autres auteurs ont suggéré que les femmes atteintes de MAI spécifiques à prépondérance féminine manifestent une inactivation asymétrique de l’X dans les globules blancs de leur sang périphérique, comme le confirment les données sur la sclérodermie et les maladies thyroïdiennes auto-immunes, alors que dans la cirrhose, nous n'avons pas réussi à démontrer cette inactivation préférentielle.
Tableau 1 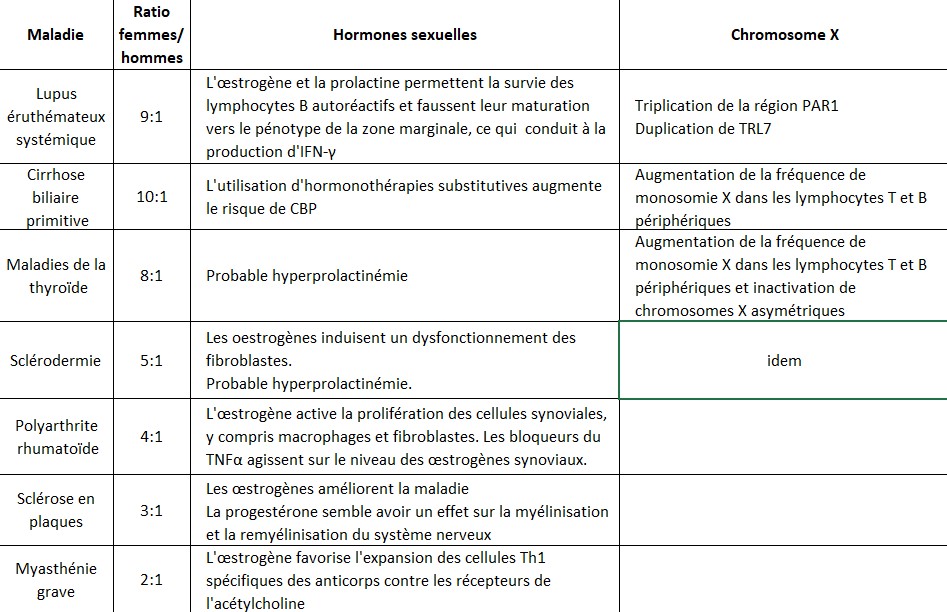
- Oublions-nous l'auto-immunité chez les hommes ?
Est-il possible que les hommes soient moins diagnostiqués de MAI pour d’autres raisons que les vraies différences sexuelles des taux de prévalence ? Lorsque l'on considère les MAI avec leur début et leur progression subtils, c’est une question difficile qu’il ne faut pourtant pas négliger. En effet, nous ne pouvons pas actuellement exclure la possibilité que la sensibilisation des médecins joue un rôle dans la probabilité de déterminer un éventuel diagnostic de MAI. Pour soutenir cette hypothèse, il faut considérer l'exemple inverse des maladies coronariennes à prédominance masculine pour lesquelles un test vidéo a été réalisé. Cette étude a démontré que femmes et hommes évalués par leur médecin généraliste pour les symptômes typiques font l'objet de soins sensiblement différents. En fait, on pose moins de questions aux femmes et on leur ordonne moins de tests et moins de consultations spécialisées.
Il faut aussi noter que peu de MAI disposent de marqueurs diagnostiques permettent d'identifier tous les cas dans les études populationnelles. En conséquence, la plupart des études sont basées sur des méthodes de recherche de cas et ne tiennent compte que des cas déjà diagnostiqués. Est-il possible que ce mécanisme conduise à identifier plus de cas féminins ? Le cas de la cirrhose biliaire est assez paradigmatique puisqu'aucune donnée populationnelle n'est disponible (également en raison du manque de sensibilité pour les auto-anticorps sériques).
Les sex-ratios diffèrent significativement entre des études de recherche de cas et des études de dépistage sur un grand nombre de sérums, bien que les nombres dans ce dernier cas soient significativement plus petits. Ce défaut possible est également étayé par les données des études familiales où l'écart entre hommes et femmes et leurs apparentés de premier degré est significativement plus faible que les chiffres proposés dans les séries cliniques.
- Conclusions et orientations futures
La pathogenèse de toute MAI reconnaît le rôle nécessaire des facteurs environnementaux et de la susceptibilité génétique conduisant à une rupture de tolérance, et les femmes semblent être plus sujettes au développement de MAI pour ces deux facteurs. Nous avons examiné ici les mécanismes proposés, mais il est clair qu'aucun d'entre eux n'a atteint un consensus définitif et certains problèmes doivent être résolus. Premièrement, tous les aspects ont été développés, comme discuté pour l’inhibition de X ou bien représentés par de nouveaux acteurs tels que les microARN ou l'acétylation des histones, et cela ne peut être négligé. Deuxièmement, nous sommes convaincus que l'étude de l'auto-immunité féminine ne peut être complète sans une évaluation minutieuse des cas masculins qui doivent être absolument tous collectés.
Troisièmement, le rôle des hormones sexuelles, en particulier des œstrogènes, devrait être réévalué avec des outils de recherche plus modernes. En fin de compte, l'étude des différences sexuelles dans l'auto-immunité aidera à une meilleure définition des mécanismes conduisant à la caractérisation clinique de MAI très différentes, permettant notamment une définition claire des cas les plus susceptibles de progresser ou de présenter des complications majeures et aussi de développer de nouvelles approches thérapeutiques.
Messages à retenir
- Les données issues de l'épidémiologie des maladies auto-immunes, en particulier celles qui surviennent plus tard dans la vie, soutiennent une prédominance féminine pour la plupart.
- Le système immunitaire humain présente un dimorphisme sexuel et les réponses immunitaires de base diffèrent entre femmes et hommes en termes de production d'anticorps et des réponses cellulaires.
- Les hormones sexuelles ont d'abord été désignées en raison de leurs effets sur la production de cytokines, la maturation des cellules B, le guidage des lymphocytes, la présentation des antigènes et les différences de reproduction entre les femmes avec et sans auto-immunité. Cependant, les études ne sont pas concluantes.
- La microchimérisme peut induire une auto-immunité chez la femme, mais les observations précédentes dans la sclérodermie ne sont pas confirmées.
- Les défauts majeurs du chromosome X sont plus fréquents chez les femmes atteintes de MAI tardives, tandis que les données sur les schémas d'inactivation de X sont incohérentes.
- Les cliniciens ne doivent pas exclure la possibilité que les maladies auto-immunes soient négligées chez les hommes.
Bibliographie
Lleo A, Battezzati PM, Selmi C, Gershwin ME, Podda M
Is autoimmunity a matter of sex ?
Autoimmun Rev. 2008 Sep;7(8):626-30
DOI : 10.1016/j.autrev.2008.06.009
Et pour aller plus loin
Profil de nos 5000 abonnés
| Par catégorie professionnelle | |
| Médecins | 27% |
| Professions de santé | 33% |
| Sciences de la vie et de la terre | 8% |
| Sciences humaines et sociales | 12% |
| Autres sciences et techniques | 4% |
| Administration, services et tertiaires | 11% |
| Economie, commerce, industrie | 1% |
| Médias et communication | 3% |
| Art et artisanat | 1% |
| Par tranches d'âge | |
| Plus de 70 ans | 14% |
| de 50 à 70 ans | 53% |
| de 30 à 50 ans | 29% |
| moins de 30 ans | 4% |
| Par motivation | |
| Patients | 5% |
| Proche ou association de patients | 3% |
| Thèse ou études en cours | 4% |
| Intérêt professionnel | 65% |
| Simple curiosité | 23% |
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Maladie mentale et fécondité - D’un point de vue évolutionniste, puisque les maladies mentales ne confèrent a priori aucun [...]
Génétique et évolution en médecine - La génétique et l'évolution ont émergé dans les années 1850 et 1860 avec les travaux de [...]
Impact du thé sur la mortalité au XVIII° siècle - Cet article explore l’impact de la qualité de l’eau sur la mortalité en exploitant une [...]
Amylase chez l’homme et les animaux domestiques - Le riz, le pain et les pommes de terre ne sont que quelques-uns des aliments féculents dont [...]
Evolution du système immunitaire - 1/ Introduction Cet article examine le développement de la réponse immunitaire depuis le [...]
Vous aimerez aussi ces humeurs...
Revenir à la preuve clinique des médicaments - Jusqu’aux années 1920, tous les médicaments efficaces étaient hérités de l’empirisme [...]
Quel avenir pour les seins plats ? - Lorsqu’un marché s’annonce mirobolant par l’énormité de sa clientèle potentielle, [...]
Guerres des drogues - En 1839, la guerre de l’opium a illustré la diversité des armes que peut utiliser un pays [...]
N’épousez pas de vieux messieurs - À leur naissance, les femmes ont un stock limité d’ovocytes dont certains subiront une [...]
Des ménagères aux patients - Les radios de service public ont su épargner à leurs auditeurs les publicités pour [...]
La phrase biomédicale aléatoire
L'imprudence est une vertu clinique
― Marc Grassin et Frédéric Pochard
