Critique de l'épigénétique transgénérationnelle
dernière mise à jour le 23/11/2024
Abstract
L’hérédité épigénétique transgénérationnelle désigne la transmission d’informations épigénétiques par la lignée germinale. Bien qu’elle ait été observée chez les plantes, les nématodes et les mouches à fruits, son apparition chez les mammifères – et les humains en particulier – fait l’objet de débats controversés, principalement parce que l’étude de l’hérédité épigénétique transgénérationnelle est confondue avec l’hérédité génétique, écologique et culturelle. Dans cet article, je discute du phénomène de l’hérédité épigénétique transgénérationnelle et de la difficulté d’en fournir des preuves concluantes dans des études expérimentales et observationnelles.
Épigénétique et hérédité cellulaire
Bien que toutes les cellules somatiques d’un organisme multicellulaire aient le même génome, les différents types de cellules ont des transcriptomes différents (ensemble de toutes les molécules d’ARN exprimées), des protéomes différents (ensemble de toutes les protéines) et, par conséquent, des fonctions différentes. La différenciation cellulaire au cours du développement embryonnaire nécessite l’activation et la répression d’ensembles spécifiques de gènes par l’action de facteurs de transcription définissant la lignée cellulaire. Au sein d’une lignée cellulaire, les états d’activité des gènes sont souvent maintenus sur plusieurs cycles de divisions cellulaires (un phénomène appelé « mémoire cellulaire » ou « hérédité cellulaire »). Depuis la redécouverte de l’épigénétique il y a une trentaine d’années (elle avait été initialement proposée par Conrad Hal Waddington au début des années 1940), l’hérédité cellulaire a été attribuée aux boucles de rétroaction régulatrices des gènes, aux modifications de la chromatine (méthylation de l’ADN et modifications des histones) ainsi qu’aux molécules d’ARN non codantes à longue durée de vie, qui sont collectivement appelées « épigénome ». Parmi les différentes modifications de la chromatine, la méthylation de l'ADN et le silençage médié par les protéines polycomb sont probablement les plus stables et confèrent aux génomes la capacité d'imposer le silençage de la transcription de séquences spécifiques même en présence de tous les facteurs nécessaires à leur expression.
Définition de l'hérédité épigénétique transgénérationnelle
La métastabilité de l’épigénome explique pourquoi le développement est à la fois plastique et canalisé, comme l’avait initialement proposé Waddington. Bien que l’épigénétique ne traite que de l’hérédité cellulaire de la chromatine et des états d’expression des gènes, il a été suggéré que les caractéristiques épigénétiques pourraient également être transmises par la lignée germinale et persister dans les générations suivantes. L’intérêt généralisé pour « l’hérédité épigénétique transgénérationnelle » est nourri par l’espoir que les mécanismes épigénétiques pourraient fournir une base à l’hérédité des traits acquis. Oui, Lamarck n’est jamais mort et relève la tête de temps à autre, cette fois avec l’aide de l’épigénétique.
Bien que les traits acquis concernant les fonctions corporelles ou cérébrales puissent être inscrits dans l’épigénome d’une cellule, ils ne peuvent pas être facilement transmis d’une génération à l’autre. Pour que cela se produise, ces changements épigénétiques devraient également se manifester dans les cellules germinales, qui chez les mammifères sont séparées des cellules somatiques par la barrière théorique de Weismann. De plus, la chromatine est considérablement remodelée au cours de la différenciation des cellules germinales ainsi que pendant le développement des cellules totipotentes après la fécondation, même si certains loci semblent échapper à la reprogrammation épigénétique dans la lignée germinale. Les molécules d’ARN à longue durée de vie semblent être moins affectées par ces barrières et donc plus susceptibles de transmettre des informations épigénétiques à travers les générations, bien que les mécanismes soient encore obscurs.
Preuves de l'hérédité épigénétique transgénérationnelle
Au cours des dix dernières années, de nombreux rapports sur les réponses transgénérationnelles aux facteurs environnementaux ou métaboliques chez la souris et le rat ont été publiés. Ces facteurs comprennent les perturbateurs endocriniens, les régimes riches en graisses, l'obésité, le diabète, la sous-alimentation ainsi que les traumatismes. Ces études ont examiné la méthylation de l'ADN, l'ARN du sperme ou les deux. Wei a découvert que le prédiabète induit par la streptozotocine chez les souris mâles affectait les schémas de méthylation de l'ADN dans le sperme ainsi que dans les îlots pancréatiques des descendants de première et deuxième génération. Gapp a découvert que le stress traumatique au début de la vie modifiait les processus comportementaux et métaboliques de la progéniture et que l'injection d'ARN du sperme de mâles traumatisés dans des ovocytes sauvages fécondés reproduisait les altérations chez la progéniture résultante. Si la plupart des études publiées sont techniquement solides, la majorité d'entre elles attendent encore une confirmation indépendante ; Les études sur les effets transgénérationnels des perturbateurs endocriniens et d’un régime alimentaire riche en graisses sur le méthylome de l’ADN ont récemment été contestées par d’autres.
Chez l’homme, des études épidémiologiques ont établi un lien entre l’approvisionnement alimentaire de la génération des grands-parents et les résultats de santé des petits-enfants. Une étude indirecte basée sur des analyses de méthylation et de polymorphisme de l’ADN a suggéré que les défauts d’empreinte sporadiques du syndrome de Prader-Willi sont dus à l’hérédité d’une empreinte de méthylation grand-mère par la lignée germinale mâle. En raison du caractère unique de ces cohortes humaines, ces résultats attendent encore une réplication indépendante. Cependant, la plupart des cas de ségrégation de profils de méthylation anormale de l’ADN dans les familles atteintes de maladies rares se sont avérés être causés par une variante génétique sous-jacente.
Programmation fœtale et hérédité intergénérationnelle
L’hérédité génétique ne peut à elle seule expliquer pourquoi nous ressemblons à nos parents. En plus des gènes, nous avons hérité de nos parents l’environnement et la culture, qui ont été en partie construits par les générations précédentes (Fig. 1a). Une forme spécifique de l’environnement est le ventre de notre mère, auquel nous avons été exposés pendant les 9 premiers mois de notre vie. L’environnement maternel peut avoir des effets durables sur notre santé. Au cours de l’hiver de la faim aux Pays-Bas, par exemple, une grave sous-alimentation a touché les femmes enceintes, leur progéniture à naître et les cellules germinales fœtales de cette dernière. L’incidence accrue de maladies cardiovasculaires et métaboliques observée chez les adultes F1 (première génération) n’est pas due à la transmission d’informations épigénétiques par la lignée germinale maternelle, mais à une conséquence directe de l’exposition in utero, un phénomène appelé « programmation fœtale » ou – si les cellules germinales fœtales et la progéniture F2 (deuxième génération) sont affectées – « hérédité intergénérationnelle ».
Fig. 1
Systèmes d'hérédité transgénérationnelle.
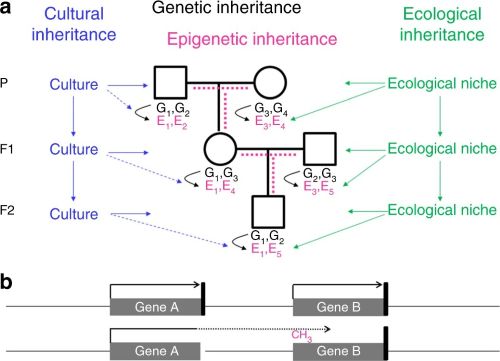
a Les descendants héritent de leurs parents les gènes (noir), l'environnement (vert) et la culture (bleu). Les gènes et l'environnement affectent l'épigénome (magenta) et le phénotype. La culture affecte également le phénotype, mais à l'heure actuelle, il n'existe aucune preuve d'un effet direct de la culture sur l'épigénome (lignes bleues en pointillés). La quantité d'informations épigénétiques héritées par la lignée germinale (lignes magenta en pointillés) est sujette à débat. G variante génétique, E variante épigénétique.
b Une épimutation (méthylation du promoteur et silençage du gène B dans cet exemple) résulte souvent d'une transcription aberrante en lecture continue à partir d'un gène voisin mutant, soit en orientation sens comme indiqué ici, soit en orientation antisens. La présence d'une telle épimutation secondaire dans plusieurs générations d'une famille imite l'hérédité épigénétique transgénérationnelle, bien qu'elle représente en fait l'hérédité génétique. Flèche noire, transcription ; barre verticale noire, signal de terminaison de la transcription ; flèche en pointillé, transcription en lecture continue
Épimutations secondaires
L'épigénome est caractérisé par le fait qu'il est influencé par les gènes et l'environnement. L'effet de la culture est moins clair à l'heure actuelle ; s'il y a un effet, il s'agit probablement d'un effet indirect, par la construction de niches. Les parents et les enfants peuvent partager les mêmes caractéristiques épigénomiques, mais il est extrêmement difficile de déterminer si ces caractéristiques ont été transmises par la lignée germinale ou établies à nouveau à chaque génération par l'action de gènes et d'environnements partagés.
Plusieurs études, dont une étude récente de Guéant, ont rapporté la co-ségrégation d'un modèle de méthylation anormale de l'ADN (appelé « épimutation ») avec une maladie rare sur deux générations ou plus de certaines familles. Dans ces cas, la méthylation anormale de l'ADN du gène étudié était liée à une mutation dans un gène voisin qui supprimait le signal de terminaison de la transcription (Fig. 1b). En conséquence, la transcription de ce gène s'est étendue au gène étudié, provoquant une méthylation anormale du promoteur et le silençage du gène. Contrairement à une épimutation primaire, qui se produit indépendamment de tout changement de séquence d'ADN, il s'agit d'une épimutation secondaire, qui dépend strictement de l'expression du gène voisin muté. Si ce gène est également exprimé dans la lignée germinale, comme dans les familles décrites par Guéant, l'épimutation est également trouvée dans les cellules germinales, ce qui ne doit pas être confondu avec une hérédité épigénétique transgénérationnelle. La véritable hérédité épigénétique transgénérationnelle dépendrait de la présence d'une épimutation primaire dans les cellules germinales ayant un effet direct sur le phénotype de la progéniture.
Feuille de route pour prouver l'hérédité épigénétique transgénérationnelle
1/ Éliminer l'hérédité génétique, écologique et culturelle. Pour les études sur les souris et les rats, il faut utiliser des souches consanguines et des environnements strictement contrôlés. Lorsqu'une femelle enceinte est exposée à un stimulus environnemental spécifique, la progéniture F3 et les générations suivantes doivent être étudiées afin d'exclure un effet direct du stimulus sur les cellules somatiques et germinales des embryons. Il est encore plus souhaitable d'avoir recours à la fécondation in vitro (FIV), au transfert d'embryons et à des mères adoptives. Lorsqu'un animal mâle est exposé à un stimulus environnemental, la progéniture F2 doit être étudiée afin d'exclure des effets transitoires sur les cellules germinales. Pour garantir qu'un phénotype est exclusivement transmis par les gamètes, il faut utiliser la FIV, en contrôlant les éventuels artéfacts liés à la FIV. Contrairement aux animaux de laboratoire, il est impossible d'exclure l'hérédité écologique et culturelle chez l'homme, mais les effets génétiques doivent et peuvent être exclus. Si une épimutation semble suivre des modèles d'hérédité mendéliens, soyez prudent : vous êtes plus probablement en présence d'une épimutation secondaire et d'un héritage génétique. Étudiez le contexte haplotypique de l'épimutation : si dans une famille donnée, il s'agit toujours du même haplotype, il s'agit probablement d'une épimutation secondaire. Effectuez un séquençage du génome entier, comme l'a fait Guéant, pour rechercher une variante génétique qui aurait pu causer l'épimutation et sachez que cette variante pourrait être située à distance. Les bons endroits pour commencer à chercher sont les deux gènes voisins, où une mutation pourrait provoquer une lecture transcriptionnelle en orientation sens ou antisens dans le locus étudié. Malheureusement, si vous ne trouvez rien, vous ne pouvez toujours pas être sûr à 100 % qu'une variante génétique n'existe pas.
2/ Identifier le facteur épigénétique responsable dans les cellules germinales. Certes, cela est plus facile à dire qu'à faire, en particulier dans le cas des cellules germinales féminines, qui sont rares ou indisponibles. Sachez que les préparations de cellules germinales peuvent être contaminées par des cellules somatiques ou de l'ADN somatique. Utilisez des techniques de nage (spermatozoïdes) ou de micromanipulation pour purifier les cellules germinales jusqu'à la plus grande pureté. Exclure la présence de cellules somatiques et d'ADN somatique par des tests moléculaires, par exemple par une analyse de méthylation des gènes imprimés, qui sont entièrement méthylés ou entièrement non méthylés uniquement dans les cellules germinales.
3/ Démontrer que le facteur épigénétique dans les cellules germinales est responsable de l'effet phénotypique dans la génération suivante. Si possible, retirer le facteur des cellules germinales affectées et démontrer que l'effet est perdu. Ajouter le facteur aux cellules germinales témoins et démontrer que l'effet est acquis. Alors que les molécules d'ARN peuvent être et ont été extraites du sperme des animaux exposés et injectées dans des zygotes témoins, la méthylation de l'ADN et les modifications des histones ne peuvent pas être facilement manipulées (bien que des éditeurs d'épigénome basés sur CRISPR/Cas9 soient développés et utilisés à cette fin), et toutes ces expériences peuvent difficilement être réalisées sur les humains. À la lumière de ces problèmes, cela pourrait être actuellement trop demander pour prouver l'hérédité épigénétique transgénérationnelle chez les humains, mais devrait néanmoins être gardé à l'esprit et discuté.
L'héritage transgénérationnel à la lumière de l'évolution
Chez les plantes, les nématodes et les mouches à fruits, l’hérédité épigénétique transgénérationnelle est bien documentée. Il a été avancé que cette forme d’hérédité pourrait permettre à une population de s’adapter à des environnements fluctuants. La question est de savoir si cela est également vrai pour les mammifères et, en particulier, pour les humains. Presque tous les modèles expérimentaux sur souris et les quelques observations chez les humains concernent des traits délétères (malformations congénitales, anxiété, intolérance au glucose, obésité, maladies cardiovasculaires, cancer et décès prématuré) ; une exception semble être la cicatrisation des plaies hépatiques. Cela peut être dû, au moins en partie, à un biais de déclaration, car les effets négatifs sont plus faciles à repérer que les effets positifs, mais dans l’ensemble, cela jette un doute sur le rôle adaptatif de l’hérédité épigénétique transgénérationnelle dans ces cas. Le fait que l’hérédité transgénérationnelle des marques de chromatine soit si rarement observée chez les mammifères peut être un effet secondaire de la reprogrammation épigénétique extensive nécessaire au développement des cellules germinales et à l’embryogenèse précoce chez les mammifères, qui pourrait également servir de mécanisme pour empêcher la transmission des agressions environnementales que les animaux ont rencontrées au cours de leur vie.
De manière plus générale, la transmission d’informations épigénétiques entre générations réduit la plasticité développementale et oriente le développement de la progéniture dans une direction particulière. Cela peut aider les animaux à reproduction rapide à s’adapter rapidement à un nouvel environnement et à augmenter la taille de leur population. Si, en revanche, l’environnement « anticipé » ne correspond pas à l’environnement réel, la progéniture sera mal adaptée et sa capacité de reproduction sera réduite. Cela est particulièrement vrai pour les humains, qui sont susceptibles de rencontrer des environnements différents au cours de leur longue vie.
En conclusion, même si des mécanismes moléculaires permettant de transmettre l’information épigénétique d’une génération à l’autre existent chez l’homme, il est très probable que la transmission transgénérationnelle de la culture par la communication, l’imitation, l’enseignement et l’apprentissage dépasse les effets de l’hérédité épigénétique et notre capacité à détecter ce phénomène. L’hérédité culturelle a certainement joué un rôle adaptatif dans l’évolution de notre espèce, mais les preuves de l’hérédité épigénétique transgénérationnelle, telles qu’exposées ci-dessus, ne sont pas (encore) concluantes. Pour l’instant, je reste sceptique.
Bibliographie
Horsthemke, B. A
Critical view on transgenerational epigenetic inheritance in humans
Nat Commun 9 2973 2018
DOI : 10.1038/s41467-018-05445-5
Et pour aller plus loin
Profil de nos 5000 abonnés
| Par catégorie professionnelle | |
| Médecins | 27% |
| Professions de santé | 33% |
| Sciences de la vie et de la terre | 8% |
| Sciences humaines et sociales | 12% |
| Autres sciences et techniques | 4% |
| Administration, services et tertiaires | 11% |
| Economie, commerce, industrie | 1% |
| Médias et communication | 3% |
| Art et artisanat | 1% |
| Par tranches d'âge | |
| Plus de 70 ans | 14% |
| de 50 à 70 ans | 53% |
| de 30 à 50 ans | 29% |
| moins de 30 ans | 4% |
| Par motivation | |
| Patients | 5% |
| Proche ou association de patients | 3% |
| Thèse ou études en cours | 4% |
| Intérêt professionnel | 65% |
| Simple curiosité | 23% |
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi ces humeurs...
L’inégalité d’accès aux soins n’est plus ce qu’elle était - Dans les années 1960, vingt ans après la création de la sécurité sociale, les dépenses de [...]
Dépistages inutiles - Un dépistage est dit systématique, organisé ou généralisé quand il s’applique à tous [...]
Monogamie évolutionniste - Les statistiques déplaisent, car elles ignorent les cas particuliers ; chacun assimilant [...]
Gestation pour autrui : dernières affres du "tout génétique" - Le sujet des mères porteuses est très médiatique, car il ressasse l’impossibilité de choisir [...]
Coucou la socialité de la GPA - La biologie a classé et nommé les comportements sociaux caractéristiques des espèces. Les [...]
Vous aimerez aussi...
Adaptation au pôle Nord - Sélection environnementale au cours de la dernière période glaciaire sur la transmission de la [...]
Troubles psychiatriques et traits reproductifs chez la femme - Relation génétique possible entre les traits reproductifs de la femme et six troubles [...]
Adaptation aux petites proies - Les auteurs de cette étude émettent l'hypothèse que les extinctions de la mégafaune tout au [...]
La mutation qui protège des maladies à prions - Un cas pratique d'évolution darwinienne a pu être mis en évidence dans une tribu de [...]
Longévité et taux de mutations - Le vieillissement peut être dû à l’accumulation de mutations tout au long de la vie, [...]
La phrase biomédicale aléatoire
Les mots diagnostiques ont un poids plus élevé que les autres. En posant un objet-maladie sur un individu, le médecin déborde le cadre de la lésion organique ou du trouble fonctionnel. La portée sociale du mot posé peut avoir de grandes répercussions psychiques. Les mots de la biomédecine réassignent les positions sociales, professionnelles et familiales. Les médecins produisent plus d’angoisses par leurs mots qu’ils n’en peuvent soulager par leurs comprimés.
― Luc Perino
Vous aimerez aussi ces humeurs...
Les religions sont-elles cliniques - En ces périodes troubles où une partie non négligeable de l’humanité se remet à tuer au [...]
Grossesse, tabac et autres drogues - Nul ne peut ignorer que fumer pendant la grossesse est très nocif pour l’embryon, le fœtus, [...]
Monogamie évolutionniste - Les statistiques déplaisent, car elles ignorent les cas particuliers ; chacun assimilant [...]
D’accord mais de mort lente - La « pression parasitaire » est l’ensemble des infections qui menacent une espèce. [...]
Passoires et tamis - Notre société est atteinte de « litigiosité » chronique. L’imagination des procéduriers [...]
