Statut socio-économique et cerveau
dernière mise à jour le 17/01/2025
Statut socioéconomique et cerveau : perspectives mécanistes issues de la recherche sur les humains et les animaux
Abstract
Le développement du cerveau humain se déroule dans un contexte socioéconomique qui influence le développement neuronal de l’enfant, en particulier celui des systèmes qui sous-tendent le langage et les fonctions exécutives. Des recherches menées sur des modèles humains et animaux ont mis en évidence l’implication de facteurs prénataux, d’interactions parents-enfants et de stimulation cognitive dans l’environnement familial dans les effets du statut socioéconomique sur le développement neuronal. Ces résultats offrent une occasion unique de comprendre comment les facteurs environnementaux peuvent conduire à des différences individuelles dans le développement cérébral et d’améliorer les programmes et les politiques conçus pour atténuer les disparités liées au statut socioéconomique en matière de santé mentale et de réussite scolaire.
Introduction
Au fur et à mesure que le domaine des neurosciences humaines a évolué, il est passé de la description du cerveau humain « typique » ou « moyen » à la caractérisation des différences individuelles dans la structure et le fonctionnement du cerveau et à l'identification de leurs déterminants. Le statut socioéconomique (SSE) qui mesure le statut et la position globale d'un individu dans la société, influence fortement les expériences d'un individu depuis l'enfance jusqu'à l'âge adulte. La recherche commence à mettre en lumière les mécanismes par lesquels les expériences du monde social pendant la petite enfance affectent la structure et le fonctionnement du cerveau.
Grandir dans une famille à faible statut socio-économique est associé à une santé nettement moins bonne et à un bien-être psychologique altéré, ainsi qu’à un développement cognitif et émotionnel altéré tout au long de la vie 1 – 6 . Contrairement aux approches sociologiques et épidémiologiques, les neurosciences peuvent identifier les systèmes cognitifs et affectifs sous-jacents qui sont influencés par le statut socio-économique ( Encadré 1 ). En outre, les recherches en neurosciences – chez les animaux et chez les humains – ont fourni des mécanismes potentiels pour les relations de cause à effet entre le statut socio-économique et le développement neuronal. Ces recherches ont également démontré qu’au moins certains de ces effets sont réversibles. Une telle compréhension mécaniste permettra de concevoir des interventions plus spécifiques et plus efficaces pour prévenir et remédier aux effets d’un faible statut socio-économique pendant l’enfance 7 – 9 .
Encadré 1 Le rôle des neurosciences dans la lutte contre les disparités liées au statut socioéconomique.
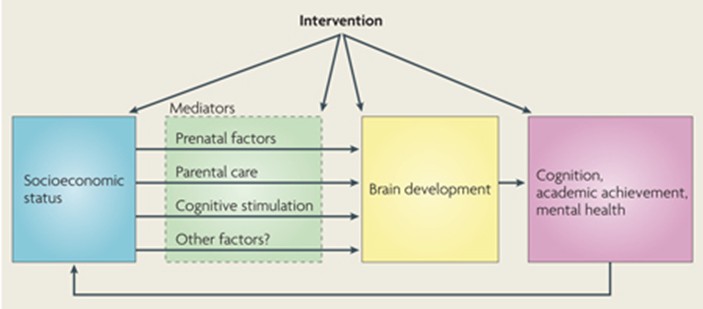
Le statut socioéconomique (SSE) a des effets sur la cognition, la réussite scolaire et la santé mentale. Les recherches sur le développement du cerveau nous permettent d’identifier les différences dans les systèmes neuronaux cognitifs et affectifs qui sous-tendent les effets du SSE sur la cognition, la réussite scolaire et la santé mentale. En outre, les recherches en neurosciences sur les animaux et les humains peuvent fournir des candidats médiateurs biologiquement plausibles pour expliquer les relations de cause à effet entre le SSE et le développement neuronal. Ces médiateurs comprennent les facteurs prénataux, les soins parentaux et la stimulation cognitive, ainsi que d’autres mécanismes possibles ( Encadré 2 ). Il est également probable que les effets du SSE pendant la petite enfance sur la cognition, la réussite scolaire et la santé mentale influenceront l’avancement socioéconomique à l’âge adulte. Chaque aspect de ce schéma (voir la figure) est également une cible potentielle pour les programmes d’intervention et de prévention. Ces programmes pourraient chercher à influencer, premièrement, le SSE directement ; deuxièmement, les médiateurs candidats des effets du SSE ; troisièmement, les aspects du développement cérébral par le biais de stratégies qui incluent l’entraînement de fonctions neurocognitives spécifiques ; et enfin, la réussite scolaire ou la psychopathologie par le biais de changements dans les programmes ou la thérapeutique. En identifiant de nouvelles cibles d’intervention et en fournissant une explication plus complète des mécanismes à l’origine des disparités liées au statut socio-économique, la recherche en neurosciences permettra de concevoir des interventions spécifiques et fondées sur la théorie pour prévenir et remédier aux effets d’un faible statut socio-économique pendant l’enfance.
D’autres revues récentes ont abordé la recherche sur les différences liées au statut socio-économique dans le développement neurocognitif 7 – 9 . Dans cette perspective, nous nous concentrons sur les mécanismes potentiels par lesquels le statut socio-économique influence le développement cérébral, en nous appuyant sur des recherches menées sur des humains et sur des modèles animaux. Nous décrivons d’abord des études menées sur des humains qui montrent que le statut socio-économique influence les fonctions cognitives et affectives chez les enfants, les adolescents et les jeunes adultes. Nous discutons ensuite des études menées sur des populations humaines qui ont identifié des médiateurs possibles des effets du statut socio-économique, et passons en revue les recherches menées sur des animaux dans lesquelles ces facteurs ont été directement manipulés pour évaluer leur effet sur les résultats de la progéniture.
Effets du SES sur la santé mentale et la cognition
Le statut socio-économique est une construction complexe qui repose sur le revenu du ménage, les ressources matérielles, l’éducation et la profession, ainsi que sur les caractéristiques du quartier et de la famille, comme l’exposition à la violence et aux toxines, les soins parentaux et la mise à disposition d’un environnement stimulant sur le plan cognitif 2 , 5 , 10 , 11 (pour les controverses concernant la mesure et la définition des niveaux du statut socio-économique, voir les références 1 , 10 , 11 ). Non seulement la strate la plus basse, mais tous les niveaux du statut socio-économique affectent le développement affectif et cognitif à des degrés divers 1 , 12 – 14 . Cela implique que les effets du statut socio-économique qui sont examinés ici sont pertinents pour l’ensemble de la population, même s’il convient de noter que les effets les plus marqués sont souvent observés chez les personnes ayant les niveaux de statut socio-économique les plus bas.
Comparativement aux enfants et adolescents issus de milieux socio-économiques aisés, les enfants et adolescents issus de milieux socio-économiques défavorisés présentent des taux plus élevés de dépression, d'anxiété, de problèmes d'attention et de troubles du comportement 12 , 15 – 18 , ainsi qu'une prévalence plus élevée de comportements d'intériorisation (c'est-à-dire de type dépressif ou anxieux) et d'extériorisation (c'est-à-dire agressifs et impulsifs) 6 , 19 – 21 , qui augmentent tous avec la durée de la paupérisation 12 , 21 . De plus, le statut socio-économique de l'enfance influence le développement cognitif ; il est positivement corrélé à l'intelligence et à la réussite scolaire depuis la petite enfance jusqu'à l'adolescence 2 , 3 , 6 , 14 , 19 , 22 , 23 .
Ces effets sont susceptibles d’expliquer, au moins en partie, la persistance de la pauvreté au fil des générations 24 : les individus issus de milieux socio-économiques défavorisés durant l’enfance sont confrontés à divers obstacles sociaux et économiques à la réussite et au bien-être, et ce avec l’inconvénient supplémentaire d’une moins bonne santé, d’une résilience émotionnelle réduite et de capacités cognitives altérées.
SES et systèmes neurocognitifs
Il est difficile de discerner les mécanismes qui sous-tendent le lien entre le statut socio-économique et l’intelligence, la performance scolaire et la santé mentale, car chacune des variables de résultat (QI, réussite scolaire et classifications diagnostiques) reflète le fonctionnement de multiples systèmes cognitifs et socio-émotionnels sous-jacents. Par conséquent, une approche prometteuse pour comprendre comment le statut socio-économique affecte ces variables de résultat consiste à identifier les différences liées au statut socio-économique dans les systèmes neuronaux cognitifs et affectifs sous-jacents ( Encadré 1 ).
Le statut socio-économique de l’enfant affecte certains systèmes neurocognitifs plus que d’autres. Des études ayant évalué plusieurs systèmes neurocognitifs ont révélé que les effets les plus importants du statut socio-économique concernent le traitement du langage, avec des effets plus modérés sur la fonction exécutive, en particulier sur la mémoire de travail et le contrôle cognitif 13 , 25 – 27 . De plus, certaines études ont constaté des effets modérés du statut socio-économique sur la mémoire déclarative et la cognition spatiale 13 , 25 , 28 , 29 .
Des études axées sur le développement du langage ont montré un effet du statut socio-économique sur le vocabulaire, la conscience phonologique (la capacité à réfléchir sur le son et la structure du langage ; une capacité importante pour apprendre à lire) et la syntaxe 30 . Par exemple, une étude ancienne et influente a estimé que le vocabulaire des enfants américains de 3 ans issus de familles professionnelles est deux fois plus important que celui des enfants issus de familles bénéficiant de l'aide sociale 31 . Des différences structurelles dans les zones cérébrales temporales et pariétales impliquées dans le langage n'ont pas été constatées selon les niveaux socio-économiques chez les enfants 32 . Cependant, le statut socio-économique était positivement corrélé au degré d'activation du gyrus frontal inférieur gauche (par rapport au droit) pendant une tâche linguistique chez les jeunes enfants 33 , ce qui indique une spécialisation réduite de la fonction linguistique dans l'hémisphère gauche chez les enfants ayant un statut socio-économique faible. De plus, l'activité fusiforme gauche pendant la lecture était positivement corrélée à la conscience phonologique chez les enfants de statut socio-économique inférieur, mais pas chez les enfants de statut socio-économique supérieur 34 .
Des différences liées au statut socio-économique dans les fonctions exécutives de la mémoire de travail et du contrôle inhibiteur ont été observées chez des enfants dès l'âge de 6 à 14 mois 35 . Des différences liées au statut socio-économique dans les systèmes attentionnels exécutifs ont été signalées chez des enfants de 6 ans 36 , et des disparités liées au statut socio-économique dans diverses tâches de la fonction exécutive ont été décrites à plusieurs stades de développement jusqu'au début de l'adolescence 13 , 25 , 26 , 37-39 . De même, le statut socio-économique influence la mémoire de travail verbale et spatiale chez les enfants et les adolescents 13 , 25 , 26 , 40 et la mémoire de travail spatiale à la fin de l'adolescence 41 . Certaines études ne trouvent pas de différences liées au statut socio-économique dans toutes les tâches de la fonction exécutive 40,42,44 , bien que cette absence d'effet puisse s'expliquer en partie par des critères d'exclusion rigoureux, résultant en des échantillons avec des enfants à faible statut socio-économique particulièrement sains et capables. Des études menées sur des adultes montrent des disparités similaires liées au statut socio-économique dans les tâches mesurant la flexibilité cognitive, l’apprentissage et la mémoire verbale immédiate et la fluidité verbale 45 .
Il existe également des différences liées au statut socio-économique dans le degré auquel des systèmes neuronaux spécifiques sont recrutés pendant les tâches de fonction exécutive, même lorsque les performances de la tâche ne diffèrent pas entre les groupes socio-économiques. Par exemple, les potentiels évoqués (PRE) révèlent que les enfants de statut socio-économique faible présentent des réponses plus importantes aux stimuli non surveillés, ce qui indique une difficulté à supprimer la distraction au début du flux de traitement et donc une attention sélective réduite 46 , 47 . De plus, comme mesuré par les PRE, les enfants de statut socio-économique faible ne recrutent pas les circuits d'attention préfrontaux en réponse à de nouveaux stimuli de distraction au même degré que les enfants de statut socio-économique élevé 27 . De plus, dans une tâche basée sur l'IRM fonctionnelle qui exige que le sujet applique des règles de stimulus-réponse familières et apprenne de nouvelles règles, les enfants de statut socio-économique faible recrutent préférentiellement le gyrus frontal moyen droit lorsqu'ils apprennent de nouvelles règles (l'activation dans cette région est inversement proportionnelle à la précision dans l'application de la nouvelle règle).
Il existe également des preuves de différences liées au statut socio-économique dans le traitement neuronal des émotions. Les adolescents de statut socio-économique inférieur présentent une activité cérébrale gauche plus faible au repos, telle que mesurée par l'asymétrie alpha au repos sur les sites frontaux, un schéma généralement observé chez les patients souffrant de dépression 48 . Chez les étudiants, un statut social subjectif inférieur est associé à une réponse amygdalienne accrue aux visages en colère 49 . Chez les adultes, un statut social subjectif inférieur est lié à un volume plus petit du cortex cingulaire antérieur périgénual 50 , une région fonctionnellement connectée à l'amygdale et impliquée dans la régulation des états émotionnels et le risque de troubles affectifs 51 , 52 .
En résumé, il existe des preuves de différences marquées entre les différents groupes socio-économiques en termes de langage et de fonctions exécutives, ainsi que des preuves émergentes de différences dans d’autres processus cognitifs et affectifs. Les fonctions exécutives semblent être particulièrement importantes pour obtenir des résultats positifs dans la vie malgré l’adversité chez les enfants et les adolescents issus de groupes socio-économiques défavorisés 53 , 54 . Les déficiences des fonctions exécutives sont également impliquées dans divers troubles affectifs et comportementaux, et le développement du langage et des fonctions exécutives pendant l’enfance est important pour la réussite scolaire 55 – 59 . Les différences individuelles dans ces systèmes neurocognitifs sont déterminées en partie par le statut socio-économique et ces systèmes apparaissent donc comme des voies potentielles par lesquelles le statut socio-économique pourrait compromettre la réussite scolaire et augmenter le risque de maladie mentale.
Démêler la cause et l’effet
L’association entre le statut socio-économique et le fonctionnement du cerveau humain pourrait indiquer que les expériences typiques des différents niveaux de statut socio-économique affectent le développement du cerveau (« causalité sociale »). Elle pourrait également indiquer que les différences de fonctionnement du cerveau prédisposent les individus à un niveau particulier de réussite socio-économique et, par conséquent, à un statut socio-économique particulier (« sélection sociale »). Les deux possibilités ne s’excluent pas mutuellement et peuvent opérer à différents moments du développement, de sorte que, par exemple, la causalité sociale peut expliquer les effets liés au statut socio-économique sur le développement neurocognitif pendant l’enfance et l’adolescence, qui au fil du temps peuvent inhiber la réussite socio-économique et donc le statut socio-économique à l’âge adulte. En outre, il est possible que la variation génomique, de concert avec le contexte environnemental, puisse influencer à la fois le statut socio-économique familial et le développement de l’enfant, et que la variation génétique puisse interagir avec le statut socio-économique pour influencer les résultats du développement neurologique. Néanmoins, les données actuelles indiquent que les différences liées au statut socio-économique dans le développement neuronal reflètent, au moins en partie, des causes sociales.
Dans le domaine de la santé mentale, les preuves de l'hypothèse de la causalité sociale des différences liées au statut socio-économique dans la prévalence de la dépression et de l'anxiété sont solides (bien que la sélection sociale puisse également opérer dans la schizophrénie, car le statut socio-économique des personnes atteintes de schizophrénie est susceptible de diminuer en raison de leur maladie et des déficiences liées à la maladie) 18 , 20 , 60 , 61 . De plus, une « expérience » naturelle dans laquelle un sous-ensemble d'une population a reçu un supplément de revenu soudain a révélé que même de faibles changements de revenu pour les familles pauvres conduisent à une diminution des taux de problèmes de santé mentale chez les enfants, en particulier pour les comportements d'extériorisation cliniquement significatifs 62 . Cela non seulement étaye l'hypothèse de la « causalité sociale » mais indique également que le fardeau excessif de la santé mentale des familles à faible statut socio-économique peut être au moins en partie réversible par des changements de revenu. En outre, les résultats d'une étude sur des jumeaux indiquent que l'hérédité des problèmes d'intériorisation peut être modifiée par le statut socio-économique. Ici, l’environnement représentait un pourcentage plus élevé de la variation de l’internalisation aux niveaux socio-économiques faibles 63 .
Dans le domaine du fonctionnement cognitif, il existe de nombreuses preuves que les contextes environnementaux exercent une influence causale 64 . Des études de placement croisé qui ont comparé des enfants adoptés au sein ou entre des niveaux socio-économiques ont également trouvé une forte composante environnementale dans les différences de QI liées au niveau socio-économique, ce qui confirme encore une fois l'hypothèse de la causalité sociale 65 . Cette approche peut en fait avoir sous-estimé les effets environnementaux, car l'hypothèse implicite est que les facteurs environnementaux prénataux sont génétiques plutôt qu'environnementaux. De plus, l'impact de la pauvreté est plus important si la pauvreté est vécue dans la petite enfance plutôt que tard 3 , 12 et cela est difficile à expliquer en termes d'héritabilité seule. Des études comparant des jumeaux mono- et di-zygotes indiquent également que l'ampleur des effets génétiques sur le QI dépend du niveau socio-économique, de sorte que la capacité cognitive est presque entièrement prédite par des facteurs environnementaux à des niveaux socio-économiques inférieurs 66 . Ainsi, en plus des effets connus de la variation génomique sur la fonction exécutive 67 , il est probable que le développement de la fonction exécutive soit influencé par l'environnement, en particulier à des niveaux socio-économiques inférieurs. Il convient également de noter que les estimations des effets environnementaux dans les études sur les jumeaux dépendent de la variance de l'environnement au sein de l'échantillon, de sorte que si la variation du statut socio-économique est insuffisante, les effets environnementaux globaux sont susceptibles d'être sous-estimés. De plus, les effets du statut socio-économique et du génotype interagissent pour produire des phénotypes tels que la réactivité de la sérotonine à la fenfluramine et la capacité d'attention 68 , 69 . Enfin, certains aspects du développement neuronal qui sont influencés par le statut socio-économique, comme la fonction exécutive, sont également sensibles à l'intervention. Cela est cohérent avec l'hypothèse de la « causalité sociale » et démontre que les différences peuvent être au moins en partie réversibles 59 , 70 , 71 .
Aucun facteur environnemental ne saurait expliquer à lui seul tous les effets du statut socio-économique, et il est probable que des facteurs spécifiques influent sur des aspects spécifiques du développement neurologique. Deux facteurs environnementaux pourraient expliquer les différences de développement neurocognitif liées au statut socio-économique : l’accès aux soins de santé et à l’éducation, qui sont tous deux plus favorables aux enfants issus de niveaux socio-économiques plus élevés. Pourtant, ils ne peuvent pas expliquer entièrement les effets du statut socio-économique. Par exemple, les gradients d’effets du statut socio-économique sur la santé persistent dans les pays où les soins de santé sont universels 1 , et les effets du statut socio-économique sur la cognition et le développement neurologique apparaissent tôt dans l’enfance, avant que les enfants n’aient reçu une éducation formelle approfondie 13 , 14 , 19 , 26 , 31 , 33 , 35 – 39 , 47 .
Mécanismes candidats aux effets du SES
Le statut socio-économique influence la qualité de l’environnement physique et psychosocial tout au long du développement 5 . Des facteurs environnementaux, comme l’exposition à la stimulation cognitive à la maison, les toxines, la nutrition, l’exposition prénatale aux médicaments et le stress — y compris le stress parental et ses effets associés sur les pratiques parentales et les interactions parents-enfants — pourraient atténuer les effets du statut socio-économique sur le cerveau ( Encadré 2 ). Par conséquent, le défi consiste à identifier les mécanismes sous-jacents par lesquels le statut socio-économique influence le développement du cerveau. Des hypothèses concernant ces mécanismes peuvent être formulées et testées en intégrant des données issues d’études sur des humains et de modèles animaux, dont chacun présente des forces et des faiblesses différentes et complémentaires ( Encadré 3 ). Nous nous concentrons sur les trois mécanismes potentiels sous-jacents aux effets du statut socio-économique sur le développement neurocognitif qui bénéficient du plus large soutien empirique : les facteurs prénataux, les soins parentaux et la stimulation cognitive.
Encadré 2 | L’écologie du statut socio-économique.
Outre la qualité de l'éducation parentale et l' environnement intra-utérin et familial, d'autres facteurs peuvent influer sur les effets du statut socio-économique (SSE) sur le développement neuronal. Ces facteurs comprennent :
- Exposition aux toxines : les enfants issus de milieux défavorisés présentent des niveaux accrus de plomb dans le sang 5 . Le plomb est une neurotoxine qui affecte le QI 143 et la réussite scolaire, affectant particulièrement la capacité de lecture 144 .
- Nutrition : les nutriments et l’apport calorique influencent les mécanismes neuronaux qui sous-tendent la cognition et l’émotion 145 . Les familles à faible statut socio-économique ont moins accès à des aliments sains et sont plus susceptibles de souffrir d’insuffisance alimentaire et de carence nutritionnelle 5 .
- Exposition prénatale aux drogues : il existe peu de preuves que l’exposition prénatale aux drogues contribue de manière significative aux disparités socio-économiques relevées dans cet article. Bien que la consommation d’alcool et de drogues pendant la grossesse soit liée au statut socio-économique, la direction de cette relation varie selon la substance. En particulier, la consommation d’alcool est moins fréquente chez les femmes enceintes de statut socio-économique faible 146 , 147 . De plus, les effets de l’exposition prénatale à la cocaïne semblent être relativement faibles lorsque les effets d’autres facteurs, comme l’environnement familial, sont pris en compte 148 .
- Stress : le stress affecte les relations familiales, y compris les relations avec les enfants. Les familles à faible statut socio-économique subissent un stress accru lié au rang social, aux difficultés à subvenir aux besoins de la famille, au fait de vivre dans des quartiers dangereux et à d'autres facteurs. Cela peut entraîner un stress chronique et ainsi nuire au développement de l'enfant 5 , 95 , 149 , 150 . Des recherches menées sur des animaux et des humains ont montré que le stress altère spécifiquement le contrôle attentionnel 151 , 152 , et que les indicateurs d'exposition au stress chronique jouent un rôle médiateur dans la relation entre le statut socio-économique de l'enfant et la mémoire de travail 41 .
Encadré 3 | Recherche animale et humaine.
Les modèles animaux fournissent des informations importantes sur les effets du statut socio-économique (SSE) sur le développement du cerveau, même si les animaux n’ont pas de SSE en soi . Néanmoins, les modèles animaux sont capables de capturer de nombreuses composantes et corrélats du SSE – y compris les facteurs prénataux, le comportement parental postnatal et la stimulation cognitive – et permettent un niveau de contrôle expérimental sur ces facteurs qui n’est ni possible ni souhaitable dans les études sur les humains. De plus, chez les humains, ces médiateurs environnementaux présumés des effets du SSE sont corrélés les uns aux autres. La recherche sur les animaux permet d’isoler leurs effets et de révéler des interactions synergiques entre eux. Bien entendu, il existe des limites à l’adéquation des modèles animaux au développement humain, en particulier lorsque des phénomènes sociaux et culturels ont de l’intérêt. Le stress induit expérimentalement chez un rat, par exemple par une contention physique, peut ne pas refléter les aspects psychosociaux du stress ressenti par un humain en difficulté économique. En outre, la mesure dans laquelle les soins parentaux ou la stimulation cognitive correspondent entre les animaux et les humains est sans aucun doute faible. De même, bien que des efforts puissent être faits pour utiliser des mesures de résultats parallèles de certaines tâches de fonction exécutive dans la recherche sur les humains et les animaux, les modèles animaux de performance linguistique ou de certains aspects de la fonction exécutive, comme la mémoire de travail verbale, manquent évidemment. Chez les humains, les facteurs médiateurs sont également imbriqués dans des contextes plus larges qui peuvent être influents, comme les différences entre la pauvreté rurale et urbaine 5 . Il est donc crucial de tester directement les hypothèses concernant les causes sous-jacentes des effets du statut socio-économique, par d’autres moyens que la manipulation expérimentale des principaux mécanismes candidats dans les modèles animaux. Cela peut être accompli en utilisant l’analyse statistique de médiation, des expériences naturelles, des études d’intervention 70 , 141 et des stratégies telles que des mesures répétées et décalées dans le temps, la modélisation par équation structurelle et les scores de propension 1 pour aider à renforcer les inférences causales. En utilisant la neuroimagerie et des mesures moléculaires ainsi que des mesures comportementales plus conventionnelles, cette approche pourrait en principe étudier des mécanismes neuronaux spécifiques qui, selon la recherche sur les animaux, pourraient sous-tendre les effets du statut socio-économique sur la cognition et la santé mentale.
Influences prénatales
Un faible statut socio-économique chez les femmes enceintes augmente le risque d'accouchement prématuré et de retard de croissance du fœtus 72 , deux facteurs prédictifs d'une augmentation des taux de maladie mentale infantile et de mauvais résultats scolaires 73 – 77 . Un faible statut socio-économique est également associé à des niveaux plus élevés de stress, à des taux d'infection plus élevés et à une mauvaise nutrition pendant la grossesse. Tous ces facteurs augmentent les taux plasmatiques de facteur de libération de la corticotropine (CRF) et de glucocorticoïdes chez la mère et le fœtus 75 , 78 – 80 et peuvent ainsi freiner la croissance du fœtus 75 , 78 et déclencher la prématurité 79 . L'administration de glucocorticoïdes pendant la grossesse est associée à une augmentation du comportement d'extériorisation, de la timidité, de la distractibilité et de l'inattention, ainsi qu'à un QI plus faible chez les enfants 81 . De plus, même un poids de naissance modestement faible est lié à un volume hippocampique plus petit chez les adultes 82 . Ces résultats suggèrent que les conditions associées à un faible statut socio-économique compromettent la croissance du fœtus et le développement neurologique, avec des effets ultérieurs sur la fonction neurale qui persistent à l'âge adulte.
Chez les rongeurs, l'administration prénatale ou périnatale de glucocorticoïdes aux femelles enceintes réduit le poids du cerveau à la naissance, inhibe la neurogenèse et retarde la maturation neuronale, la myélinisation, la gliogenèse et la formation des synapses 78 . De plus, le stress maternel pendant la grossesse diminue la densité des épines dendritiques dans de nombreuses zones du cerveau liées à la régulation des émotions, notamment l'hippocampe, le cortex cingulaire antérieur et le cortex orbitofrontal 83 , et augmente les réponses comportementales et hormonales au stress chez la progéniture à l'âge adulte 75 , 78 , 84 – 86 . Les effets sur la réactivité au stress à l'âge adulte sont abolis par la normalisation des taux de glucocorticoïdes pendant la grossesse 87 . Chez les macaques rhésus, l'exposition fœtale à des taux élevés de glucocorticoïdes réduit le volume de l'hippocampe à l'âge adulte 88 . La progéniture des macaques rhésus femelles qui ont été stressées pendant la grossesse présente un poids à la naissance réduit, un développement neuromoteur altéré, des déficits de l'attention et une dysrégulation émotionnelle tout au long de la vie 89 . De plus, des données ont été recueillies chez les rongeurs montrant que les influences prénatales sur l’activité de l’axe hypothalamo-hypophyso-surrénalien (HHS) peuvent être transmises de génération en génération de manière épigénétique 90 (voir ci-dessous). Ces résultats suggèrent que chez les femmes enceintes, les facteurs de stress associés à un faible statut socio-économique prédisent des issues de grossesse qui imitent les effets d’une exposition accrue aux glucocorticoïdes fœtaux sur le développement neurologique et qui peuvent persister de génération en génération. Par conséquent, il est probable que les effets du statut socio-économique puissent émerger au cours du développement fœtal.
Soins parentaux
Il est peu probable que les facteurs prénataux expliquent tous les effets du statut socio-économique sur le développement neurologique, en particulier parce que les effets du statut socio-économique sont souvent encore apparents même après contrôle du poids à la naissance 91 . Le stress parental postnatal influence le développement de l'enfant en diminuant l'implication et les soins parentaux, comme le décrit le modèle de stress familial 4 . Chez l'humain, un faible statut socio-économique est associé à une plus grande irritabilité et à des humeurs dépressives et anxieuses chez les parents, ce qui compromet les interactions parents-enfants 92 , 93 . Le stress parental conduit à une discipline sévère et incohérente, à une moindre sensibilité aux besoins de l'enfant, à une communication verbale réduite et, chez les enfants, à un attachement insécurisant au principal dispensateur de soins 6 , 31 , 92 – 95 . Les conflits familiaux et les comportements parentaux problématiques — y compris (mais sans s'y limiter) la discipline sévère et incohérente, la négligence et la maltraitance — sont associés à tous les niveaux du statut socio-économique à des problèmes émotionnels et comportementaux chez les enfants. Ces problèmes ne sont pas seulement observés lorsqu'ils sont mesurés simultanément, de sorte que la qualité parentale est corrélée aux schémas émotionnels et comportementaux de l'enfant, mais également lorsqu'ils sont mesurés de manière prospective, car la qualité de la parentalité antérieure prédit les schémas émotionnels et comportementaux des enfants des années plus tard 93 , 94 , 96 – 98 .
Les soins parentaux, et en particulier la discipline parentale, la communication verbale parent-enfant et la sensibilité aux besoins émotionnels de l'enfant, atténuent au moins partiellement les effets du statut socio-économique sur la fonction émotionnelle et cognitive des enfants 6 , 19 , 91 , 99 . Des interactions parents-enfants de haute qualité sont associées à la résilience chez les enfants qui vivent dans des environnements stressants et pauvres 100 . De plus, les programmes cliniques qui visent à améliorer les pratiques parentales dans les familles pauvres et à haut risque améliorent les résultats comportementaux et cognitifs des enfants 101 – 103 , fournissant des preuves expérimentales qui sont cohérentes avec le rôle de la parentalité comme médiateur des effets du statut socio-économique. La qualité des soins parentaux dans la petite enfance prédit, dans une étude longitudinale d'un échantillon de statut socio-économique faible, une meilleure mémoire déclarative et un volume hippocampique plus petit chez les adolescents de statut socio-économique faible, et ces associations sont indépendantes de la stimulation cognitive (voir ci-dessous) et de l'intelligence maternelle 104 , 105 .
Des études sur les rongeurs et les primates non humains ont mis en évidence des effets directs du stress sur la qualité des interactions mère-enfant et sur l'expression génétique et le développement neurologique. Chez les macaques à bonnet, l'accès restreint à la nourriture est un facteur de stress qui altère considérablement les interactions mère-enfant, ce qui augmente à son tour la réactivité au stress chez la progéniture adolescente, reflétant un effet durable des soins parentaux 106 . De même, chez les rongeurs, la fréquence de léchage et de toilettage des petits par la mère est diminuée par le stress chronique imposé pendant la grossesse 107 , 108 . Les variations de la fréquence de léchage et de toilettage des petits rats sont associées à des changements dans les systèmes neuronaux qui régulent les réponses comportementales et HPA au stress à l'âge adulte ( Figure 1 ). La réponse HPA au stress chez les mammifères est en grande partie médiée par la libération de CRF par l'hypothalamus, qui est sous le contrôle de la rétroaction négative des glucocorticoïdes, en partie par l'activation des récepteurs des glucocorticoïdes dans l'hippocampe. Les descendants adultes de mères qui lèchent et toilettent fréquemment leurs petits montrent une expression accrue des récepteurs des glucocorticoïdes hippocampiques, des niveaux de CRF hypothalamiques diminués et des réponses HPA au stress plus modestes par rapport aux descendants de mères qui lèchent et toilettent peu 109 – 113 . Les descendants adultes de mères qui lèchent et toilettent fréquemment ont également une expression accrue des gènes des sous-unités du récepteur GAbA A (acide γ-aminobutyrique de type A) dans l'amygdale qui régulent les influences inhibitrices sur les réponses au stress, rendant les animaux moins craintifs 109 , 110 . Des études de croisement chez le rat ont révélé des effets directs des soins maternels postnatals (c'est-à-dire indépendants des influences génomiques) sur la physiologie de l'hippocampe et sur la réponse au stress chez les descendants adultes 110 , 112 . Il est important de noter que chez les rats, le stress chronique pendant la grossesse altère la qualité des interactions mère-enfant 108 , réduisant la fréquence de léchage des petits chez la mère et augmentant la réactivité au stress chez la progéniture 112 , et ces effets peuvent être transmis de génération en génération 114 . Ces résultats récapitulent le thème qui ressort des études sur le statut socio-économique et la parentalité humaine, à savoir que les environnements stressants altèrent la qualité de la parentalité et donc les résultats développementaux.
Figure 1. Régulation parentale de l’axe hypothalamo-hypophyso-surrénalien.
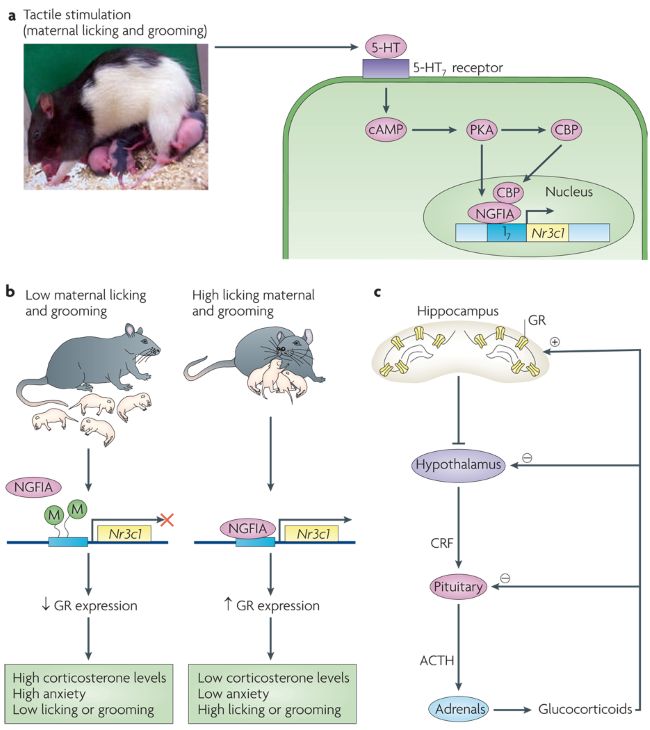
a | Le modèle de travail actuel concernant l'effet des soins maternels (en particulier le léchage et le toilettage des chiots) sur la régulation épigénétique de l'expression de Nr3c1 , le gène qui code le récepteur des glucocorticoïdes (GR). Le léchage et le toilettage des chiots activent les augmentations dépendantes de l'hormone thyroïdienne des taux de sérotonine hippocampique (5-hydroxytryptamine ou 5-HT) et la liaison de la 5-HT au récepteur 5-HT 7 . L'activation du récepteur 5-HT 7 conduit à l'activation d'une cascade d'AMP cyclique–protéine kinase A (PKA) qui induit l'expression du facteur de transcription NGFIA (nerf growth factor-inducible A) et de la protéine de liaison à l'élément de réponse à l'AMP cyclique (CREB) (CBP) et leur association avec le promoteur du gène GR de l'exon 17 spécifique des neurones.
b | Chez les nouveau-nés, des niveaux élevés de léchage augmentent l'association de NGFIA et de CBP avec le promoteur de l'exon 17 en déclenchant la déméthylation d'une séquence de dinucléotides (CpG) située dans la région de liaison de NGFIA de l'exon. Cela augmente ensuite la capacité de NGFIA à activer l'expression du gène GR. M, méthylation.
c | Schéma de l'axe hypothalamo-hypophyso-surrénalien, dont le pivot sont les neurones à facteur de libération de la corticotropine (CRF) du noyau paraventriculaire de l'hypothalamus. Le CRF est libéré dans le système porte de l'hypophyse antérieure, stimulant la synthèse et la libération d'adrénocorticotropine (ACTH), qui stimule ensuite la libération de glucocorticoïdes surrénaliens. Les glucocorticoïdes agissent sur les GR dans plusieurs régions du cerveau, y compris l'hippocampe, pour inhiber la synthèse et la libération de cRF (c'est-à-dire qu'une rétroaction négative des glucocorticoïdes a lieu). Les descendants adultes de mères qui se lèchent et se toilettent fréquemment, par rapport à ceux de mères qui se lèchent et se toilettent peu, montrent une expression accrue de GR, une sensibilité accrue à la rétroaction négative aux glucocorticoïdes, une expression réduite de CRF dans l'hypothalamus et des réponses hypophyso-surrénaliennes au stress plus modestes.
Des études sur des rats ont suggéré que des mécanismes épigénétiques médiatisent l'effet des soins maternels sur l'expression des récepteurs des glucocorticoïdes hippocampiques. Ce mécanisme implique la méthylation de l'ADN, qui affecte la structure de la chromatine et régule ainsi la liaison des facteurs de transcription et, par la suite, la transcription des gènes 115 . À l'âge adulte, les descendants de mères qui lèchent et toilettent fréquemment présentent une méthylation de la cytosine réduite du site de liaison du facteur de transcription inductible par le facteur de croissance nerveuse A ( NGFIA , également connu sous le nom d'EGR1) qui se trouve dans le promoteur de l'exon 17 de N1r3c1 (le gène qui code le récepteur des glucocorticoïdes dans l'hippocampe) ; cela entraîne une augmentation de la liaison du NGFIA à ce promoteur, une augmentation de l'expression des récepteurs des glucocorticoïdes hippocampiques et des réponses plus modestes de l'HPA au stress 113 , 116 , 117 . Chez l'homme, la maltraitance infantile est associée à une augmentation de la méthylation du promoteur du gène du récepteur des glucocorticoïdes exon 1F (l'homologue de l'exon 17 chez le rat) dans l'hippocampe 118 . Ces résultats suggèrent que les effets des soins parentaux peuvent être médiés par un mécanisme épigénétique similaire chez l'homme, bien qu'il reste à déterminer si les différences de statut socio-économique dans l'enfance sont associées à des différences de méthylation de l'ADN et d'expression génétique.
Les variations dans les soins maternels chez les rats influencent également le développement synaptique dans les régions du cerveau qui régulent la fonction cognitive. Le léchage et le toilettage des petits augmentent les niveaux de récepteurs NMDA ( N -méthyl- d -aspartate) dans l'hippocampe et l'expression hippocampique des facteurs de croissance (facteur neurotrophique dérivé du cerveau et facteur de croissance des fibroblastes basiques), qui favorisent respectivement l'activation neuronale et la synaptogenèse 119 , 120 . La progéniture adulte de mères qui procurait un léchage et un toilettage élevés montrent une densité synaptique accrue 119 , 121 et une plus grande capacité de plasticité synaptique dans l'hippocampe et le cortex préfrontal ( in vivo 122 ou in vitro 121 ), et des performances améliorées dans les formes d'apprentissage et de mémoire dépendantes de l'hippocampe et du cortex préfrontal 119 , 122 . Les effets sur le développement synaptique et les performances cognitives sont inversés avec le placement croisé 119 , ce qui indique que les soins parentaux ont des effets directs sur le développement neuronal qui sont cohérents avec ceux rapportés dans les études sur le développement cognitif chez les enfants.
Il convient de noter que même si la majorité des recherches décrites ci-dessus se concentrent sur les soins maternels, en particulier dans les modèles animaux, il n’est pas nécessairement vrai que chez les humains, seules les interactions mère-enfant influencent le développement cognitif et émotionnel de la progéniture. Il est probable que les soins attentionnés et de soutien prodigués par les parents, quel que soit leur sexe, ou par d’autres membres de la communauté soient importants pour le développement de l’enfant 123 . Le point important est que le contexte social et économique plus large peut influencer la qualité des soins parentaux, qui influencent ensuite l’activité des systèmes neuronaux qui régulent la réactivité au stress et la cognition chez la progéniture par le biais de la régulation épigénétique de l’expression des gènes.
L'environnement familial : stimulation cognitive
Le statut socio-économique influence le niveau de stimulation cognitive à la maison, comme le décrit le modèle d'investissement familial 4 , 6 . La qualité de la stimulation cognitive à la maison comprend, sans s'y limiter, des facteurs tels que la disponibilité de livres (et d'autres ressources d'alphabétisation), d'ordinateurs, de voyages et de communication parentale. Ensemble, ces facteurs peuvent expliquer les effets du statut socio-économique sur les capacités cognitives des enfants (par exemple, sur les compétences en lecture et en mathématiques 12 , 19 , 21 , 23 , 91 , 124 , 125 ) même lorsque le QI maternel a été contrôlé. L'effet peut être assez spécifique car, dans une étude longitudinale, le niveau de stimulation cognitive dans la petite enfance prédit les compétences liées au langage chez les adolescents de statut socio-économique faible, indépendamment de la qualité des soins parentaux et de l'intelligence maternelle 104 .
Des études sur des programmes d’intervention qui renforcent la stimulation cognitive apportent des preuves supplémentaires de ces effets. Ces programmes atténuent les effets d’un statut socio-économique faible sur le développement cognitif 6 , renforcent la préparation à l’école 126 et favorisent la réussite scolaire 127 , même dans les études où le fonctionnement cognitif de base et le niveau d’éducation de la mère ont été contrôlés 128 . Ces interventions renforcent également l’estime de soi et la compétence sociale 128 , et réduisent l’agressivité 129 , en particulier chez les enfants les plus défavorisés 130 . Le point essentiel est que les effets de la pauvreté sur des résultats cognitifs spécifiques peuvent être inversés, en partie, par une stimulation cognitive renforcée. Les observations de suivi à long terme des effets d’une intervention précoce, y compris des essais contrôlés randomisés, proviennent de programmes tels que le Perry Preschool Program (Michigan, États-Unis), l’Abecedarian Project (Caroline du Nord, États-Unis) et les Chicago Child–Parent Centers, États-Unis. Ces programmes incluent une stimulation cognitive accrue dans le cadre de programmes d’intervention plus complets. Les programmes d’intervention ont permis d’obtenir de meilleurs résultats aux tests de performance, des niveaux d’éducation et de revenus plus élevés et des taux d’incarcération plus faibles des décennies après la fin des programmes, malgré le fait que dans certaines études, les gains initiaux de QI ont disparu 131 – 134 . Ces effets suggèrent que même si l’expérience à tout âge affecte les résultats ultérieurs, la stimulation cognitive précoce est un déterminant particulièrement important du fonctionnement psychologique ultérieur.
Les modèles animaux fournissent également une justification solide pour la stimulation cognitive comme médiateur des effets du SES sur le développement neuronal. Hebb a observé que la complexité environnementale au cours du développement modifie un large éventail de fonctions neuronales 135 . Des études sur l'enrichissement environnemental dans lesquelles les animaux sont hébergés dans des conditions qui fournissent une stimulation sensorielle, cognitive et motrice accrue (généralement accompagnée d'une complexité sociale accrue) montrent que l'enrichissement régule à la hausse l'expression des signaux cellulaires impliqués dans la formation de synapses dépendantes de l'activité. Cela comprend les facteurs impliqués dans la signalisation glutamatergique 136 , les neurotrophines (y compris le facteur de croissance insuline-like 1, le facteur de croissance nerveuse, le facteur neurotrophique dérivé du cerveau et le facteur neurotrophique dérivé des cellules gliales) et les protéines synaptiques impliquées dans la prolifération et la fonction synaptiques 137 . L'enrichissement augmente donc la ramification dendritique, la gliogenèse et la densité synaptique dans l'hippocampe et le cortex, et favorise la neurogenèse hippocampique et l'intégration de neurones nouvellement générés dans les circuits fonctionnels 137 – 139 . Ces effets d'enrichissement sont associés à une amélioration des performances dans les tests d'apprentissage spatial et de mémoire 137 . Les rongeurs qui ont été exposés à l'adversité dans leur enfance sont plus sensibles à l'enrichissement environnemental à l'adolescence 119 , 136 , 139 . Ainsi, la recherche en neurosciences fondamentales montre comment le neurodéveloppement est affecté par les variations de la stimulation cognitive, une caractéristique qui est souvent liée au statut socio-économique.
Conclusions et implications politiques
Le statut socio-économique influence le développement cognitif et émotionnel. Néanmoins, le concept de statut socio-économique a longtemps été ignoré en neurosciences, peut-être en raison de la complexité de la construction et de la difficulté de contrôler expérimentalement ses nombreuses composantes. Les recherches présentées ici suggèrent que le statut socio-économique peut être compris dans le cadre de la recherche en neurosciences. Le statut socio-économique de l'enfant influence le développement de systèmes neuronaux spécifiques. La nature biologique de ces différences liées au statut socio-économique peut facilement être interprétée à tort comme étant plus « essentielle », innée ou immuable que les différences de comportement liées au statut socio-économique. Cependant, comme nous l'avons examiné ici, il existe peu de preuves pour étayer une telle affirmation. Au lieu de cela, des études sur les humains suggèrent que les facteurs prénataux, les interactions parents-enfants et la stimulation cognitive sous-tendent au moins en partie les effets du statut socio-économique sur le développement cérébral. Ces effets sont quelque peu spécifiques, le niveau de stimulation cognitive dans l'environnement familial prédisant le mieux le développement cognitif d'un enfant et la qualité des soins parentaux étant plus étroitement liée à son développement émotionnel. Les études sur les animaux non humains soutiennent la plausibilité biologique de ces explications. Toutefois, des recherches futures sont nécessaires pour confirmer que ces facteurs expliquent effectivement les effets du statut socio-économique sur le développement neuronal et pour appliquer ces travaux au développement d’interventions plus efficaces.
Bien que l’étude du statut socio-économique et du développement cérébral soit encore très récente, l’intégration des approches sociales et neuronales au statut socio-économique a un certain nombre d’implications politiques. Tout d’abord, elle met en évidence le développement cérébral comme nouvelle cible des programmes d’intervention et de prévention ( Encadré 1 ). Jusqu’à présent, les interventions visaient à modifier directement le statut socio-économique en augmentant le revenu familial 62 , 140 , en influençant les médiateurs présumés des effets du statut socio-économique, comme le style parental, et en influençant la réussite scolaire et la psychopathologie par des interventions directes, notamment des programmes éducatifs ou thérapeutiques ciblant les communautés à faible statut socio-économique. Le ciblage du développement cérébral a fait appel à des approches familières, comme l’amélioration de l’accès des enfants aux soins médicaux ou aux compléments alimentaires. Plus récemment, il a inclus des programmes visant à entraîner directement certains systèmes neurocognitifs, par exemple en utilisant des stratégies informatiques basées sur le jeu pour entraîner les fonctions exécutives ou des programmes scolaires qui utilisent des exercices spécifiques ainsi que des stratégies globales pour promouvoir les fonctions exécutives tout au long de la journée scolaire 59 , 70 , 71 . De telles approches semblent prometteuses du point de vue de la recherche fondamentale en neurosciences, mais les études futures doivent déterminer empiriquement si de tels programmes réduisent les disparités liées au statut socio-économique.
Deuxièmement, notre compréhension croissante des différences liées au statut socio-économique dans les systèmes neurocognitifs place ces disparités dans une perspective plus large de santé publique. Des preuves convergentes montrant que les différences dans les niveaux de soins parentaux et de stimulation cognitive à la maison sous-tendent les différences de développement cérébral liées au statut socio-économique soulignent l’importance des politiques qui façonnent les environnements plus larges auxquels les familles sont exposées. Ces preuves étendent la discussion sur le développement de l’enfant au-delà des domaines politiques traditionnels tels que l’éducation et la garde d’enfants. La priorité devrait être donnée à l’amélioration des soins aux enfants et à la création d’environnements enrichissants pendant le développement prénatal et postnatal. Par conséquent, les politiques et programmes qui réduisent le stress parental, améliorent le bien-être émotionnel des parents et fournissent des ressources adéquates aux parents et aux communautés devraient être prioritaires. De plus, comme les femmes sont souvent les principales personnes qui s’occupent d’un enfant, les effets examinés ici soulignent l’importance de la santé des femmes, du bien-être émotionnel, des ressources matérielles et de l’éducation pour le développement de l’enfant 141 .
L’intégration du SES dans la recherche en neurosciences deviendra de plus en plus importante à mesure que les neurosciences seront utilisées dans les contextes éducatifs, marketing et médico-légaux. Les applications des neurosciences dans ces contextes sont souvent développées sur la base de résultats obtenus auprès de sujets appartenant en grande partie à des SES moyens et peuvent donc ne pas être largement applicables à la population 142 . La recherche en neurosciences a un rôle unique à jouer dans la synthèse des approches de multiples disciplines, dont la sociologie, la médecine, la santé publique, la psychologie et la psychiatrie, pour caractériser les différences liées au SES dans le développement neuronal et pour cartographier les mécanismes par lesquels l’expérience de l’enfance affecte la fonction neuronale. Tout d’abord, une approche neuroscientifique nous permet d’identifier les phénotypes neuronaux liés au SES qui sous-tendent les performances cognitives et la santé mentale, et qui sont des cibles potentielles d’intervention. Deuxièmement, une compréhension du développement cérébral chez les humains et les modèles animaux peut être mise à profit pour définir la relation de cause à effet entre les « expositions liées au SES » et le développement neuronal. L’étude du statut socio-économique et du développement neuronal est un domaine d’étude prometteur qui, en décrivant les influences environnementales sur les différences individuelles dans le développement neuronal, peut affiner les stratégies pour remédier aux disparités liées au statut socio-économique.
Bibliographie
Hackman DA, Farah MJ, Meaney MJ
Socioeconomic status and the brain: mechanistic insights from human and animal research
Nat Rev Neurosci. 2010 Sep;11(9):651-9
DOI : 10.1038/nrn2897
__________________________________________________________________________________
Références
- 1.Adler NE, Rehkopf DF. US disparities in health: descriptions, causes and mechanisms. Annu. Rev. Public Health. 2008;29:235–252. doi: 10.1146/annurev.publhealth.29.020907.090852.
- 2.Bradley RH, Corwyn RF. Socioeconomic status and child development. Annu. Rev. Psychol. 2002;53:371–399. doi: 10.1146/annurev.psych.53.100901.135233.
- 3.Brooks-Gunn J, Duncan GJ. The effects of poverty on children. Future Child. 1997;7:55–71.
- 4.Conger RD, Donnellan MB. An interactionist perspective on the socioeconomic context of human development. Annu. Rev. Psychol. 2007;58:157–199. doi: 10.1146/annurev.psych.58.110405.085551.
- 5.Evans GW. The environment of childhood poverty. Am. Psychol. 2004;59:77–92. doi: 10.1037/0003-066X.59.2.77.
- 6.McLoyd VC. Socioeconomic disadvantage and child development. Am. Psychol. 1998;53:185–204. doi: 10.1037//0003-066x.53.2.185.
- 7.Hackman DM, Farah MJ. Socioeconomic status and the developing brain. Trends Cogn. Sci. 2009;13:65–73. doi: 10.1016/j.tics.2008.11.003.
- 8.Raizada RD, Kishiyama MM. Effects of socioeconomic status on brain development, and how cognitive neuroscience may contribute to levelling the playing field. Front. Hum. Neurosci. 2010;4:3. doi: 10.3389/neuro.09.003.2010.
- 9.Shonkoff JP, Boyce WT, McEwen BS. Neuroscience, molecular biology, and the childhood roots of health disparities building a new framework for health promotion and disease prevention. JAMA. 2009;301:2252–2259. doi: 10.1001/jama.2009.754.
- 10.Braveman PA, et al. Socioeconomic status in health research: one size does not fit all. JAMA. 2005;294:2879–2888. doi: 10.1001/jama.294.22.2879.
- 11.Krieger N, Williams DR, Moss NE. Measuring social class in US public health research: concepts, methodologies, and guidelines. Annu. Rev. Public Health. 1997;18:341–378. doi: 10.1146/annurev.publhealth.18.1.341.
- 12.Duncan GJ, Brooks-Gunn J, Klebanov PK. Economic deprivation and early childhood development. Child Dev. 1994;65:296–318.
- 13.Noble KG, McCandliss BD, Farah MJ. Socioeconomic gradients predict individual differences in neurocognitive abilities. Dev. Sci. 2007;10:464–480. doi: 10.1111/j.1467-7687.2007.00600.x.
- 14.Sirin SR. Socioeconomic status and academic achievement: a meta-analytic review of research. Rev. Educ. Res. 2005;75:417–453.
- 15.Merikangas KR, et al. Prevalence and treatment of mental disorders among US children in the 2001–2004 NHANES. Pediatrics. 2010;125:75–81. doi: 10.1542/peds.2008-2598.
- 16.Goodman E, Slap GB, Huang B. The public health impact of socioeconomic status on adolescent depression and obesity. Am. J. Public Health. 2003;93:1844–1850. doi: 10.2105/ajph.93.11.1844.
- 17.Shanahan L, Copeland W, Costello EJ, Angold A. Specificity of putative psychosocial risk factors for psychiatric disorders in children and adolescents. J. Child Psychol. Psychiatry. 2008;49:34–42. doi: 10.1111/j.1469-7610.2007.01822.x.
- 18.Tracy M, Zimmerman FJ, Galea S, McCauley E, Vander Stoep A. What explains the relation between family poverty and childhood depressive symptoms? J. Psychiatr. Res. 2008;42:1163–1175. doi: 10.1016/j.jpsychires.2008.01.011.
- 19.National Institute of Child Health and Human Development Early Child Care Research Network. Duration and developmental timing of poverty and children’s cognitive and social development from birth through third grade. Child Dev. 2005;76:795–810. doi: 10.1111/j.1467-8624.2005.00878.x.
- 20.Wadsworth ME, Achenbach TM. Explaining the link between low socioeconomic status and psychopathology: testing two mechanisms of the social causation hypothesis. J. Consult. Clin. Psychol. 2005;73:1146–1153. doi: 10.1037/0022-006X.73.6.1146.
- 21.Korenman S, Miller JE, Sjaastad JE. Long-term poverty and child development in the United States: results from the NLSY. Child. Youth Serv. Rev. 1995;17:127–155.
- 22.Duncan GJ, Yeung WJ, Brooks-Gunn J, Smith JR. How much does childhood poverty affect the life chances of children? Am. Sociol. Rev. 1998;63:406–423.
- 23.Guo G, Mullan-Harris KM. The mechanisms mediating the effects of poverty on children’s intellectual development. Demography. 2000;37:431–437. doi: 10.1353/dem.2000.0005.
- 24.Bowles S, Gintis H, Groves MO, editors. Unequal Chances: Family Background and Economic Success. New Jersey: Princeton Univ. Press; 2005.
- 25.Farah MJ, et al. Childhood poverty: specific associations with neurocognitive development. Brain Res. 2006;1110:166–174. doi: 10.1016/j.brainres.2006.06.072.
- 26.Noble KG, Norman MF, Farah MJ. Neurocognitive correlates of socioeconomic status in kindergarten children. Dev. Sci. 2005;8:74–87. doi: 10.1111/j.1467-7687.2005.00394.x.
- 27.Kishiyama MM, Boyce WT, Jimenez AM, Perry LM, Knight RT. Socioeconomic disparities affect prefrontal function in children. J. Cogn. Neurosci. 2009;21:1106–1115. doi: 10.1162/jocn.2009.21101.
- 28.Levine SC, Vasilyeva M, Lourenco SF, Newcombe NS, Huttonlocher J. Socioeconomic status modifies the sex difference in spatial skill. Psychol. Sci. 2005;16:841–845. doi: 10.1111/j.1467-9280.2005.01623.x.
- 29.Herrmann D, Guadagno MA. Memory performance and socioeconomic status. Appl. Cogn. Psychol. 1997;11:113–120.
- 30.Whitehurst GJ. In: Research on Communication and Language Disorders: Contribution to Theories of Language Development. Adamson LB, Romski MA, editors. Baltimore, Maryland: Brookes Publishing; 1997. pp. 233–266.
- 31.Hart B, Risley TR. Meaningful Differences in the Everyday Experience of Young American Children. Baltimore, Maryland: Brookes Publishing; 1995.
- 32.Eckert MA, Lambardino LJ, Leonard CM. Planar asymmetry tips the phonological playground and environment raises the bar. Child Dev. 2001;72:988–1002. doi: 10.1111/1467-8624.00330.
- 33.Raizada RDS, et al. Socioeconomic status predicts hemispheric specialization of the left inferior frontal gyrus in young children. Neuroimage. 2008;40:1392–1401. doi: 10.1016/j.neuroimage.2008.01.021.
- 34.Noble KG, Wolmetz ME, Ochs LG, Farah MJ, McCandliss BD. Brain-behavior relationships in reading acquisition are modulated by socioeconomic factors. Dev. Sci. 2006;9:642–654. doi: 10.1111/j.1467-7687.2006.00542.x.
- 35.Lipina SJ, Martelli MI, Vuelta B, Colombo JA. Performance on the A-not-B task of Argentinian infants from unsatisfied and satisfied basic needs homes. Int. J. Psychol. 2005;39:49–60.
- 36.Mezzacappa E. Alterting, orienting, and executive attention: developmental properties and sociodemographic correlates in and epidemiological sample of young, urban children. Child Dev. 2004;75:1373–1386. doi: 10.1111/j.1467-8624.2004.00746.x.
- 37.Ardila A, et al. The influence of the parents’ educational level on the development of executive functions. Dev. Neuropsychol. 2005;28:539–560. doi: 10.1207/s15326942dn2801_5.
- 38.Howse RB, Lange G, Farran DC, Boyles CD. Motivation and self-regulation as predictors of achievement in economically disadvantaged young children. J. Exp. Educ. 2003;71:151–174.
- 39.Hughes C, Ensor R. Executive function and theory of mind in 2 year olds: a family affair? Dev. Neuropsychol. 2005;28:645–668. doi: 10.1207/s15326942dn2802_5.
- 40.Waber DP, et al. The NIH MRI study of normal brain development: performance of a population based sample of healthy children aged 6 to 18 years on a neuropsychological battery. J. Int. Neuropsychol. Soc. 2007;13:729–746. doi: 10.1017/S1355617707070841.
- 41.Evans GW, Schamberg MA. Childhood poverty, chronic stress, and adult working memory. Proc. Natl Acad. Sci. USA. 2009;106:6545–6549. doi: 10.1073/pnas.0811910106.
- 42.Engel PMJ, Santos FH, Gathercole SE. Are working memory measures free of socioeconomic influence? J. Speech Lang. Hear. Res. 2008;51:1580–1587. doi: 10.1044/1092-4388(2008/07-0210).
- 43.Lupien SJ, King S, Meaney MJ, McEwen BS. Can poverty get under your skin? Basal cortisol levels and cognitive function in children from low and high socioeconomic status. Dev. Psychopathol. 2001;13:653–676. doi: 10.1017/s0954579401003133.
- 44.Wiebe SA, Espy KA, Charak D. Using confirmatory factor analysis to understand executive control in preschool children: I. Latent structure. Dev. Psychol. 2008;44:575–587. doi: 10.1037/0012-1649.44.2.575.
- 45.Turrell G, et al. Socioeconomic position across the lifecourse and cognitive function in late middle age. J. Gerontol. B Psychol. Sci. Soc. Sci. 2002;57:S43–S51. doi: 10.1093/geronb/57.1.s43.
- 46.D’Angiulli A, Herdman A, Stapells D, Hertzman C. Children’s event-related potentials of auditory selective attention vary with their socioeconomic status. Neuropsychology. 2008;22:293–300. doi: 10.1037/0894-4105.22.3.293.
- 47.Stevens C, Lauinger B, Neville H. Differences in the neural mechanisms of selective attention in children from different socioeconomic backgrounds: an event-related brain potential study. Dev. Sci. 2009;12:634–646. doi: 10.1111/j.1467-7687.2009.00807.x.
- 48.Tomarken AJ, Dichter GS, Garber J, Simien C. Resting frontal brain activity: linkages to maternal depression and socio-economic status among adolescents. Biol. Psychol. 2004;67:77–102. doi: 10.1016/j.biopsycho.2004.03.011.
- 49.Gianaros PJ, et al. Potential neural embedding of parental social standing. Soc. Cogn. Affect. Neurosci. 2008;3:91–96. doi: 10.1093/scan/nsn003.
- 50.Gianaros PJ, et al. Perigenual anterior cingulated morphology covaries with perceived social standing. Soc. Cogn. Affect. Neurosci. 2007;2:161–173. doi: 10.1093/scan/nsm013.
- 51.Ochsner KN, Gross JJ. The cognitive control of emotion. Trends Cogn. Sci. 2005;9:242–249. doi: 10.1016/j.tics.2005.03.010.
- 52.Ressler KJ, Mayberg HS. Targeting abnormal neural circuits in mood and anxiety disorders: from the laboratory to the clinic. Nature Neurosci. 2007;10:1116–1124. doi: 10.1038/nn1944.
- 53.Buckner JC, Mezzacappa E, Beardslee WR. Characteristics of resilient youths living in poverty: the role of self-regulatory processes. Dev. Psychopathol. 2003;15:139–162. doi: 10.1017/s0954579403000087.
- 54.Lengua LJ. The contribution of emotionality and self-regulation to the understanding of children’s response to multiple risk. Child Dev. 2002;73:144–161. doi: 10.1111/1467-8624.00397.
- 55.Duncan GJ, et al. School readiness and later achievement. Dev. Psychol. 2007;43:1428–1446. doi: 10.1037/0012-1649.43.6.1428.
- 56.Forget-Dubois N, et al. Early child language mediates the relation between home environment and school readiness. Child Dev. 2009;80:736–749. doi: 10.1111/j.1467-8624.2009.01294.x.
- 57.Morgan AB, Lilienfeld SO. A meta-analytic review of the relation between antisocial behavior and neuropsychological measures of executive function. Clin. Psychol. Rev. 2000;20:113–136. doi: 10.1016/s0272-7358(98)00096-8.
- 58.Rogers RD, et al. Executive and prefrontal dysfunction in unipolar depression: a review of neuropsychological and imaging evidence. Neurosci. Res. 2004;50:1–11. doi: 10.1016/j.neures.2004.05.003.
- 59.Blair C, Diamond A. Biological processes in prevention and intervention: the promotion of self-regulation as a means of preventing school failure. Dev. Psychopathol. 2008;20:899–911. doi: 10.1017/S0954579408000436.
- 60.Dohrenwend BP, et al. Socioeconomic status and psychiatric disorders: the causation-selection issue. Science. 1992;255:946–952. doi: 10.1126/science.1546291.
- 61.Johnson JG, Cohen P, Dohrenwend BP, Link BG, Brook JS. A longitudinal investigation of social causation and social selection processes involved in the association between socioeconomic status and psychiatric disorders. J. Abnorm. Psychol. 1999;108:490–499. doi: 10.1037//0021-843x.108.3.490.
- 62.Costello EJ, Compton SN, Keeler G, Angold A. Relationships between poverty and psychopathology: a natural experiment. JAMA. 2003;290:2023–2029. doi: 10.1001/jama.290.15.2023.
- 63.South SC, Krueger RF. Genetic and environmental influences on internalizing psychopathology vary as a function of economic status. Psychol. Med. 2010 Mar 18; doi: 10.1017/S0033291710000279. (doi:10.1017/ S0033291710000279)
- 64.Nisbett RE. Intelligence and How to Get It: Why Schools and Cultures Count. New York: Norton; 2009.
- 65.Capron C, Duyme M. Assessment of effects of socio-economic status on IQ in a full cross-fostering study. Nature. 1989;340:552–554.
- 66.Turkheimer E, Haley A, Waldron M, D’Onofrio BM, Gottesman II. Socioeconomic status modifies heritability of IQ in young children. Psychol. Sci. 2003;14:623–628. doi: 10.1046/j.0956-7976.2003.psci_1475.x.
- 67.Friedman NP, et al. Individual differences in executive function are almost entirely genetic in origin. J. Exp. Psychol. Gen. 2008;137:201–225. doi: 10.1037/0096-3445.137.2.201.
- 68.Lasky-Su J, et al. A study of how socioeconomic status moderates the relationship between SNPs encompassing BDNF and ADHD symptom counts in ADHD families. Behav. Genet. 2007;37:487–497. doi: 10.1007/s10519-006-9136-x.
- 69.Manuck SB, Flory JD, Ferrell RE, Muldoon MF. Socio-economic status covaries with central nervous system serotonergic responsivity as a function of allelic variation in the serotonin transporter genelinked polymorphic region. Psychoneuroendocrinology. 2004;29:651–668. doi: 10.1016/S0306-4530(03)00094-5.
- 70.Diamond A, Barnett WS, Thomas J, Munro S. Preschool program improves cognitive control. Science. 2007;318:1387–1388. doi: 10.1126/science.1151148.
- 71.Thorell LB, Lindqvist S, Nutley SB, Bohlin G, Klingberg T. Training and transfer effects of executive functions in preschool children. Dev. Sci. 2009;12:106–113. doi: 10.1111/j.1467-7687.2008.00745.x.
- 72.Spencer N, Bambang S, Logans S, Gill L. Socioeconomic status and birth weight: comparison of an area-based measure with the Registrar General’s social class. J. Epidemiol. Community Health. 1999;53:495–498. doi: 10.1136/jech.53.8.495.
- 73.Bohnert KM, Breslau N. Stability of psychiatric outcomes of low birth weight: a longitudinal investigation. Arch. Gen. Psychiatry. 2008;65:1080–1086. doi: 10.1001/archpsyc.65.9.1080.
- 74.Strauss RS. Adult functional outcome of those born small for gestational age: twenty-six-year follow-up of the 1970 British Birth Cohort. JAMA. 2000;283:625–632. doi: 10.1001/jama.283.5.625.
- 75.Meaney MJ, Szyf M, Seckl JR. Epigenetic mechanisms of perinatal programming of hypothalamic-pituitary-adrenal function and health. Trends Mol. Med. 2007;13:269–277. doi: 10.1016/j.molmed.2007.05.003.
- 76.Schlotz W, Phillips DIW. Fetal origins of mental health: evidence and mechanisms. Brain Behav. Immun. 2009;23:905–916. doi: 10.1016/j.bbi.2009.02.001.
- 77.Jefferis BJ, Power C, Hertzman C. Birth weight, childhood socioeconomic environment, and cognitive development in the 1958 British birth cohort study. BMJ. 2002;325:305. doi: 10.1136/bmj.325.7359.305.
- 78.Seckl JR. Glucocorticoids, developmental ‘programming’ and the risk of affective dysfunction. Prog. Brain Res. 2008;167:17–34. doi: 10.1016/S0079-6123(07)67002-2.
- 79.Challis JR, et al. The fetal placental hypothalamic-pituitary-adrenal (HPA) axis, parturition and post natal health. Mol. Cell. Endocrinol. 2001;185:135–144. doi: 10.1016/s0303-7207(01)00624-4.
- 80.McGrath S, Smith R. Prediction of preterm delivery using plasma corticotrophin-releasing hormone and other biochemical variables. Ann. Med. 2002;34:28–36. doi: 10.1080/078538902317338616.
- 81.Yeh TF, et al. Outcomes at school age after postnatal dexamethasone therapy for lung disease of prematurity. N. Engl. J. Med. 2004;350:1304–1313. doi: 10.1056/NEJMoa032089.
- 82.Buss C, Meaney MJ, Lupien S, Pruessner J. Maternal care modulates the relationship between prenatal risk and hippocampal volume. J. Neurosci. 2007;27:2592–2595. doi: 10.1523/JNEUROSCI.3252-06.2007.
- 83.Murmu MS, et al. Changes of spine density and dendritic complexity in the prefrontal cortex in offspring of mothers exposed to stress during pregnancy. Eur. J. Neurosci. 2006;24:1477–1487. doi: 10.1111/j.1460-9568.2006.05024.x.
- 84.Maccari S, et al. Prenatal stress and long-term consequences: implications of glucocorticoid hormones. Neurosci. Biobehav. Rev. 2003;27:119–127. doi: 10.1016/s0149-7634(03)00014-9.
- 85.Weinstock M. The long-term behavioural consequences of prenatal stress. Neurosci. Biobehav. Rev. 2008;32:1073–1086. doi: 10.1016/j.neubiorev.2008.03.002.
- 86.Glover V, O’Connor TG. Effects of antenatal stress and anxiety: implications for development and psychiatry. Br. J. Psychiatry. 2002;180:389–391. doi: 10.1192/bjp.180.5.389.
- 87.Barbazanges A, Piazza PV, Le Moal M, Maccari S. Maternal glucocorticoid secretion mediates long-term effects of prenatal stress. J. Neurosci. 1996;16:3943–3949. doi: 10.1523/JNEUROSCI.16-12-03943.1996.
- 88.Uno H, Tarara R, Else G, Suleman MA, Sapolsky RM. Hippocampal damage associated with prenatal glucocorticoid exposure. J. Neurosci. 1989;9:1705–1711. doi: 10.1523/JNEUROSCI.09-05-01705.1989.
- 89.Schneider ML, Moore CF, Kraemer GW, Roberts AD, DeJesus OT. The impact of prenatal stress, fetal alcohol exposure, or both on development: perspectives from a primate model. Psychoneuroendocrinology. 2002;27:285–298. doi: 10.1016/s0306-4530(01)00050-6.
- 90.Matthews SG, Phillips DIW. Minireview: transgenerational inheritance of the stress response: a new frontier in stress research. Endocrinology. 2010;151:7–13. doi: 10.1210/en.2009-0916.
- 91.Linver MR, Brooks-Gunn J, Kohen DE. Family processes as pathways from income to young children’s development. Dev. Psychol. 2002;38:719–734.
- 92.Grolnick WS, Gurland ST, DeCourcey W, Jacob K. Antecedents and consequences of mothers’ autonomy support: an experimental investigation. Dev. Psychol. 2002;38:143–155.
- 93.Belsky J, Jaffee Sin. In: Developmental Psychopathology. 2nd edn. Cicchetti D, Cohen DJ, editors. Vol. 3. New Jersey: John Wiley & Sons, Hoboken; 2006. pp. 38–85.
- 94.Repetti RL, Taylor SE, Seeman TE. Risky families: family social environments and the mental and physical health of offspring. Psychol. Bull. 2002;128:330–366.
- 95.McLoyd VC. The impact of economic hardship on Black families and children: psychological distress, parenting, and socioemotional development. Child Dev. 1990;61:311–346. doi: 10.1111/j.1467-8624.1990.tb02781.x.
- 96.Cicchetti D, Toth SL. Child maltreatment. Annu. Rev. Clin. Psychol. 2005;1:409–438. doi: 10.1146/annurev.clinpsy.1.102803.144029.
- 97.O’Connor TG, Deater-Deckard K, Fulker D, Rutter M, Plomin R. Genotype-environment correlations in late childhood and early adolescence: antisocial behavioral problems and coercive parenting. Dev. Psychol. 1998;34:970–981. doi: 10.1037//0012-1649.34.5.970.
- 98.Gunnar MR, Fisher PA. The Early Experience, Stress, and Prevention Science Network. Bringing basic research on early experience and stress neurobiology to bear on preventive interventions for neglected and maltreated children. Dev. Psychopathol. 2006;18:651–677.
- 99.Conger RD, et al. Economic stress, coercive family process, and developmental problems of adolescents. Child Dev. 1994;30:467–483.
- 100.Masten AS, Morison P, Pellegrini D, Tellegen A. In: Risk and Protective Factors in the Development of Psychopathology. Rolf JE, Marsten AS, Cicchett D, Nuechterlein KH, Weintraub S, editors. New York: Cambridge Univ. Press; 1990. pp. 236–256.
- 101.Van den Boom D. The influence of temperament and mothering on attachment and exploration: an experimental manipulation of sensitive responsiveness among lower-class mothers and irritable infants. Child Dev. 1994;65:1457–1477. doi: 10.1111/j.1467-8624.1994.tb00829.x.
- 102.Olds D, et al. Long-term effects of nurse home visitation on children’s criminal and antisocial behavior: 15-year follow-up of a randomized controlled trial. JAMA. 1998;280:1238–1244. doi: 10.1001/jama.280.14.1238.
- 103.Fisher PA, Gunnar MR, Chamberlain P, Reid JB. Preventive intervention for maltreated preschool children: impact on children’s behavior, neuroendocrine activity and foster parent functioning. J. Am. Acad. Child Adolesc. Psychiatry. 2000;39:1356–1364. doi: 10.1097/00004583-200011000-00009.
- 104.Farah MJ, et al. Environmental stimulation, parental nurturance and cognitive development in humans. Dev. Sci. 2008;15:793–801. doi: 10.1111/j.1467-7687.2008.00688.x.
- 105.Rao H, et al. Early parental care is important for hippocampal maturation: evidence from brain morphology in humans. Neuroimage. 2010;49:1144–1150. doi: 10.1016/j.neuroimage.2009.07.003.
- 106.Coplan JD, et al. Persistent elevations of cerebrospinal fluid concentrations of corticotropin-releasing factor in adult nonhuman primates exposed to early-life stressors: implications for the pathophysiology of mood and anxiety disorders. Proc. Natl Acad. Sci. USA. 1996;93:1619–1623. doi: 10.1073/pnas.93.4.1619.
- 107.Champagne FA, Meaney MJ. Stress during gestation alters postpartum maternal care and the development of the offspring in a rodent model. Biol. Psychiatry. 2006;59:1227–1235. doi: 10.1016/j.biopsych.2005.10.016.
- 108.Roth TL, Lubin FD, Funk AJ, Sweatt JD. Lasting epigenetic influence of early-life adversity on the BDNF gene. Biol. Psychiatry. 2009;65:760–769. doi: 10.1016/j.biopsych.2008.11.028.
- 109.Caldji C, et al. Maternal care during infancy regulates the development of neural systems mediating the expression of behavioral fearfulness in adulthood in the rat. Proc. Natl Acad. Sci. USA. 1998;95:5335–5340. doi: 10.1073/pnas.95.9.5335.
- 110.Caldji C, Diorio J, Meaney MJ. Variations in maternal care alter GABAA receptor subunit expression in brain regions associated with fear. Neuropsychopharmacol. 2003;28:150–159. doi: 10.1038/sj.npp.1300237.
- 111.Liu D, et al. Maternal care, hippocampal glucocorticoid receptors and HPA responses to stress. Science. 1997;277:1659–1662. doi: 10.1126/science.277.5332.1659.
- 112.Francis DD, Diorio J, Liu D, Meaney MJ. Nongenomic transmission across generations in maternal behavior and stress responses in the rat. Science. 1999;286:1155–1158. doi: 10.1126/science.286.5442.1155.
- 113.Weaver ICG, et al. Epigenetic programming through maternal behavior. Nature Neurosci. 2004;7:847–854. doi: 10.1038/nn1276.
- 114.Champagne FA. Epigenetic mechanisms and the transgenerational effects of maternal care. Front. Neuroendocrinol. 2008;29:386–397. doi: 10.1016/j.yfrne.2008.03.003.
- 115.Klose RJ, Bird AP. Genomic DNA methylation: the mark and its mediators. Trends Biochem. Sci. 2006;31:89–97. doi: 10.1016/j.tibs.2005.12.008.
- 116.Weaver ICG, et al. The transcription factor nerve growth factor-inducible protein a mediates epigenetic programming: altering epigenetic marks by immediate-early genes. J. Neurosci. 2007;27:1756–1768. doi: 10.1523/JNEUROSCI.4164-06.2007.
- 117.Murgatroyd C, et al. Dynamic DNA methylation programs persistent adverse effects of early-life stress. Nature Neurosci. 2009;12:1559–1566. doi: 10.1038/nn.2436.
- 118.McGowan PO, et al. Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse. Nature Neurosci. 2009;12:342–348. doi: 10.1038/nn.2270.
- 119.Liu D, et al. Maternal care, hippocampal synaptogenesis and cognitive development in rats. Nature Neurosci. 2000;3:799–806. doi: 10.1038/77702.
- 120.Chao MV. Neurotrophins and their receptors: a convergence point for many signalling pathways. Nature Rev. Neurosci. 2003;4:299–309. doi: 10.1038/nrn1078.
- 121.Champagne DL, et al. Maternal care alters dendritic length, spine density and synaptic potentiation in adulthood. J. Neurosci. 2008;28:6037–6045.
- 122.Bredy TW, Zhang TY, Grant RJ, Diorio J, Meaney MJ. Peripubertal environmental enrichment reverses the effects of maternal care on hippocampal development and glutamate receptor subunit expression. Eur. J. Neurosci. 2004;20:1355–1362. doi: 10.1111/j.1460-9568.2004.03599.x.
- 123.NICHD Early Child Care Research Network. Child-care effect sizes for the NICHD study of early child care and youth development. Am. Psychol. 2006;61:99–116. doi: 10.1037/0003-066X.61.2.99.
- 124.Dubow EF, Ippolito MF. Effects of poverty and quality of the home environment on changes in the academic and behavioral adjustment of elementary school-age children. J. Clin. Child Psychol. 1994;23:401–412.
- 125.Garrett P, Ng’andu N, Ferron J. Poverty experiences of young children and the quality of their home environments. Child Dev. 1994;65:331–345.
- 126.Posner JK, Vandell DL. Low-income children’s after-school care: are there beneficial effects of after-school programs? Child Dev. 1994;65:440–456.
- 127.Reynolds AJ. Effects of a preschool plus follow-on intervention for children at risk. Dev. Psychol. 1994;30:787–804.
- 128.Lee VE, Brooks-Gunn J, Schnur E, Liaw F. Are Head Start effects sustained? A longitudinal follow-up comparison of disadvantaged children attending Head Start, no preschool, and other preschool programs. Child Dev. 1990;61:495–507.
- 129.Seitz V, Rosenbaum LK, Apfel NH. Effects of family support intervention: a ten-year follow-up. Child Dev. 1985;56:376–391.
- 130.Campbell FA, Ramey CT. Cognitive and school outcomes for high-risk African-American students at middle adolescence: positive effects of early intervention. Am. Educ. Res. J. 1995;32:743–772.
- 131.Campbell FA, Pungello EP, Miller-Johnson S, Burchinal M, Ramey CT. The development of cognitive and academic abilities: growth curves from an early childhood educational experiment. Dev. Psychol. 2001;37:231–242. doi: 10.1037/0012-1649.37.2.231.
- 132.Knudsen EI, Heckman JJ, Cameron JL, Shonkoff JP. Economic, neurobiological, and behavioral perspectives on building America’s future workforce. Proc. Natl Acad. Sci. USA. 2006;103:10155–10162. doi: 10.1073/pnas.0600888103.
- 133.Reynolds AJ, Ou SR, Magnuson K. Preschool-to-third grade programs and practices: a review of research. Child. Youth Serv. Rev. 2010;32:1121–1131. doi: 10.1016/j.childyouth.2009.10.017.
- 134.Schweinhart LJ. Crime prevention by the High/Scope Perry Preschool Program. Victims & Offenders. 2007;2:141–160.
- 135.Hebb DO. The effects of early experience on problem solving at maturity. Am. Psychol. 1947;2:306–307.
- 136.Rampon C, et al. Enrichment induces structural changes and recovery from nonspatial memory deficits in CA1 NMDAR1-knockout mice. Nature Neurosci. 2000;3:238–244. doi: 10.1038/72945.
- 137.van Praag H, Kempermann G, Gage FH. Neural consequences of environmental enrichment. Nature Rev. Neurosci. 2000;1:191–198. doi: 10.1038/35044558.
- 138.Kempermann G, Kuhn HG, Gage FH. More hippocampal neurons in adult mice living in an enriched environment. Nature. 1997;386:493–495. doi: 10.1038/386493a0.
- 139.Sale A, Berardi N, Maffei L. Enrich the environment to empower the brain. Trends Neurosci. 2009;32:233–239. doi: 10.1016/j.tins.2008.12.004.
- 140.Fernald LCH, et al. Role of cash in conditional cash transfer programmes for child health, growth, and development: an analysis of Mexico’s Opportunidades. Lancet. 2008;371:828–837. doi: 10.1016/S0140-6736(08)60382-7.
- 141.Weissman MM, et al. Remission of maternal depression is associated with reductions in psychopathology in their children: a STAR*D-child report. JAM. 2006;295:1389–1398. doi: 10.1001/jama.295.12.1389.
- 142.Farah MJ. Neuroethics: the practical and the philosophical. Trends Cogn. Sci. 2005;9:34–40. doi: 10.1016/j.tics.2004.12.001.
- 143.Surkan PJ, et al. Neuropsychological function in children with blood lead levels <10 microg/dL. Neurotoxicology. 2007;28:1170–1177. doi: 10.1016/j.neuro.2007.07.007.
- 144.Miranda ML, et al. The relationship between early childhood blood lead levels and performance on end-of-grade tests. Environ. Health Perspect. 2007;115:1242–1247. doi: 10.1289/ehp.9994.
- 145.Gómez-Pinilla F. Brain foods: the effects of nutrients on brain function. Nature Rev. Neurosci. 2008;9:568–578. doi: 10.1038/nrn2421.
- 146.Abma JC, Mott FL. Substance use and prenatal care during pregnancy among young women. Fam. Plann. Perspect. 1991;23:117–128.
- 147.Caetano R, Ramisetty-Mikler S, Floyd LR, McGrath C. The epidemiology of drinking among women of child-bearing age. Alcohol. Clin. Exp. Res. 2006;30:1023–1030. doi: 10.1111/j.1530-0277.2006.00116.x.
- 148.Frank DA, Augustyn M, Knight WG, Pell T, Zuckerman B. Growth, development, and behavior in early childhood following prenatal cocaine exposure: a systematic review. JAMA. 2001;285:1613–1625. doi: 10.1001/jama.285.12.1613.
- 149.Goodman E, McEwen BS, Dolan LM, Schafer-Kalkhoff T, Adler NE. Social disadvantage and adolescent stress. J. Adolesc. Health. 2005;37:484–492. doi: 10.1016/j.jadohealth.2004.11.126.
- 150.Sapolsky RM. The influence of social hierarchy on primate health. Science. 2005;308:648–652. doi: 10.1126/science.1106477.
- 151.Liston C, et al. Stress-induced alterations in prefrontal corticial dendritic morphology predict selective impairments in perceptual attentional set-shifting. J. Neurosci. 2006;26:7870–7874. doi: 10.1523/JNEUROSCI.1184-06.2006.
- 152.Liston C, McEwen BS, Casey BJ. Psychosocial stress reversibly disrupts prefrontal processing and attentional control. Proc. Natl Acad. Sci. USA. 2009;106:912–917. doi: 10.1073/pnas.0807041106.
Et pour aller plus loin
Profil de nos 5000 abonnés
| Par catégorie professionnelle | |
| Médecins | 27% |
| Professions de santé | 33% |
| Sciences de la vie et de la terre | 8% |
| Sciences humaines et sociales | 12% |
| Autres sciences et techniques | 4% |
| Administration, services et tertiaires | 11% |
| Economie, commerce, industrie | 1% |
| Médias et communication | 3% |
| Art et artisanat | 1% |
| Par tranches d'âge | |
| Plus de 70 ans | 14% |
| de 50 à 70 ans | 53% |
| de 30 à 50 ans | 29% |
| moins de 30 ans | 4% |
| Par motivation | |
| Patients | 5% |
| Proche ou association de patients | 3% |
| Thèse ou études en cours | 4% |
| Intérêt professionnel | 65% |
| Simple curiosité | 23% |
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Microbiotes : quelques idées reçues à rectifier - Précisons d’abord la différence entre un microbiote toujours spécifique à un organe [...]
Poids de naissance et cancer - Plusieurs études montrent qu’un poids de naissance élevé est un facteur indépendant [...]
Évolution des microbiotes intestinaux de mammifères et ses conséquences sur la santé humaine - Le phénotype d’un organisme multicellulaire est généralement considéré comme le produit de [...]
Relation entre créativité et troubles de l'humeur - Résumé La recherche conçue pour examiner la relation entre la créativité et les maladies [...]
Ecologie sexuée des déplacements - Écologie sexuée des mouvements et utilisation du paysage chez les chasseurs-cueilleurs [...]
Vous aimerez aussi ces humeurs...
Pailles de la prévention - Les jours de grande pollution, de nombreux messages officiels recommandent de garder les jeunes [...]
Chemises et médicaments - Si le fait de porter une chemise rouge était source de quolibets, je pourrais néanmoins en [...]
Progrès de l'abstention dans la rhino-pharyngite - Dans les années 1920, des pédiatres et radiologues américains notèrent que les nourrissons [...]
La troisième transition épidémiologique - Une « pathocénose » désigne l’ensemble des maladies et de leurs manifestations dans [...]
Les médecins pourront signer d'une croix - Le ministère de la santé anglais vient d’émettre le projet de verser 55 Livres (70 €) aux [...]
La phrase biomédicale aléatoire
La chose qui se trouve dans les êtres vivants et qui ne se trouve pas dans les morts ; nous l'appelons Ame, Archée, Principe Vital, X, Y, Z, comme les quantités inconnues des géomètres. Il ne nous reste qu'à déterminer la valeur de cette inconnue, dont la supposition facilite, abrège le calcul des phénomènes que nous connaissons et de ceux que nous cherchons à connaître.
― Paul Joseph Barthez (courant vitaliste de Montpellier 1778)
Vous aimerez aussi ces humeurs...
Microbiotes méconnus : la flore intestinale - Les lois de l’évolution ne sont toujours pas enseignées en Faculté de Médecine, et la [...]
Scénario de scandale - Les études s’accumulent et les résultats convergent au sujet des risques liés à [...]
Cordon de sécurité - Les essais cliniques concernant des médicaments sont majoritairement biaisés, alors que ceux [...]
Cannabis et psychose - Les nostalgiques du « summer of love » ont banalisé le haschich jusqu’à lui donner [...]
Science brutalisée - L’empirisme est le premier niveau de la science. Observer des faits spontanés ou induits [...]
