Notre microbiote intestinal : l’évolution de notre moi intérieur
dernière mise à jour le 03/12/2024
Résumé
Un holobionte, défini comme la contribution collective des homologues eucaryotes et procaryotes à l’organisme multicellulaire, introduit une définition complexe de l’individualité permettant une nouvelle vision globale de l’évolution humaine et des caractéristiques personnelles.
Ici, nous fournissons des instantanés de l’évolution des associations et des relations microbiennes-hôtes au cours d’étapes distinctes de la vie d’un être humain. Nous discutons des connaissances actuelles sur la symbiose biologique entre le microbiome et son hôte et décrivons les défis à relever pour comprendre ces interactions et leurs effets potentiels sur la physiologie humaine, y compris l’interrelation entre le microbiome et le système nerveux et sa pertinence pour la variation des individualités humaines.
Introduction
Sans symbiose, la vie sur terre telle que nous la connaissons n’existerait pas. La symbiose entre les microbes et les organismes unicellulaires simples a été essentielle à l’expansion des eucaryotes multicellulaires, ainsi qu’à la diversification des espèces. De plus, toute cellule humaine porte des restes de procaryotes sous forme de mitochondries et d’organites, sans lesquels nous ne pourrions pas maintenir la vie. Les dernières décennies de recherche visant à comprendre la symbiose entre le microbiome et son hôte ont révélé de nouvelles connaissances sur les mécanismes à l’origine de processus physiologiques et physiopathologiques complexes et multifactoriels. Le microbiome, un écosystème diversifié composé principalement de commensaux et de mutualistes qui occupe différentes niches dans le corps humain, est censé interagir avec la plupart, sinon la totalité, des organes de l’hôte. Bien que le microbiome puisse varier considérablement d’un sujet à l’autre et qu’il soit influencé par la nutrition, le mode de vie, le sexe, les changements diurnes et la physiologie, il a des caractéristiques compositionnelles et fonctionnelles distinctives à travers les différentes phases de vie. On peut encore se demander si les changements microbiens au cours de la vie d’un organisme – par exemple, lors du passage de l’allaitement à une alimentation solide pendant la petite enfance, les changements hormonaux pendant la puberté, la maturation du tractus gastro-intestinal à l’âge adulte et l’inflammation chronique de faible intensité associée au vieillissement – reflètent simplement des changements biologiques secondaires se produisant à différentes périodes de la vie ou s’ils contribuent à certaines de ces transitions physiologiques liées à l’âge.
Quoi qu’il en soit, le microbiome intestinal, qui change tout au long du cycle de vie de l’hôte, est de plus en plus considéré comme un puissant contributeur physiologique au développement et à l’homéostasie.
Compte tenu des rôles physiologiques du microbiome spécifiques à la personne, des études récentes suggèrent qu’il pourrait servir de bon prédicteur du risque de maladie, des réponses glycémiques postprandiales, du risque de reprendre du poids après une perte de poids, et plus encore. Avec une meilleure compréhension de la nature et des mécanismes par lesquels un microbiome en homéostasie change au cours de la vie et des moyens par lesquels ces changements affectent les voies biologiques, on peut imaginer que les dysbioses (perturbations du microbiote) spécifiques à un âge donné peuvent permettre de prédire et de stratifier le risque de maladie dans un certain nombre de troubles humains complexes liés au mode de vie, ainsi que les maladies inflammatoires, métaboliques, néoplasiques et neurodégénératives.
Dans cette revue, nous nous concentrons sur les principales caractéristiques du microbiote intestinal, l’écosystème commensal le plus diversifié et le mieux étudié du corps humain, tout au long de la durée de vie normale des individus en bonne santé. D’autres microbiotes non gastro-intestinaux et non bactériens peuvent jouer un rôle tout aussi important dans le développement humain, mais ils sont moins étudiés ici et discutés dans d’autres études.
La période néonatale
Jusqu’à récemment, on pensait que les nouveau-nés étaient stériles et que le premier contact microbien se produisait lors de l’accouchement. On pensait que le placenta humain agissait comme une barrière empêchant les anticorps maternels, les molécules toxiques et les micro-organismes de se déplacer dans la circulation sanguine fœtale. Des découvertes récentes remettent en question ce dogme de la stérilité de l’embryon en suggérant que diverses communautés microbiennes peuvent exister dans le sperme humain et dans l’utérus. De plus, une foule d’autres études suggèrent que les espèces microbiennes parentales peuvent coloniser le placenta, le liquide amniotique et le sang de cordon ombilical. La présence d’une communauté microbienne transitoire dans le méconium confirme une voie de colonisation in utero. La comparaison de plusieurs échantillons de microbiome provenant de paires mère-progéniture a révélé des signatures microbiennes partagées entre le placenta, le liquide amniotique et le méconium, ce qui suggère que la colonisation intestinale précoce peut être initiée avant la naissance par une trajectoire distincte de microbes maternels. Le placenta et le liquide amniotique, par exemple, présentent des signatures similaires avec une diversité relativement faible et une dominance protéobactérienne (fig 1). La majorité de ces études soutiennent l’idée que le microbiote intestinal maternel est une source clé qui ensemence l’intestin fœtal. Pour tester cette hypothèse, des chercheurs ont colonisé des souris enceintes avec Enterococcus faecium génétiquement marqué isolé du lait maternel humain et ont pu cultiver avec succès la souche marquée à partir du liquide amniotique de ces souris, deux jours avant le terme. Bien que ces résultats puissent confirmer le transfert vertical d’un microbiome moins complexe chez le fœtus avant la naissance, il faut encore évaluer le risque de contamination pendant le processus d’évaluation du microbiome.
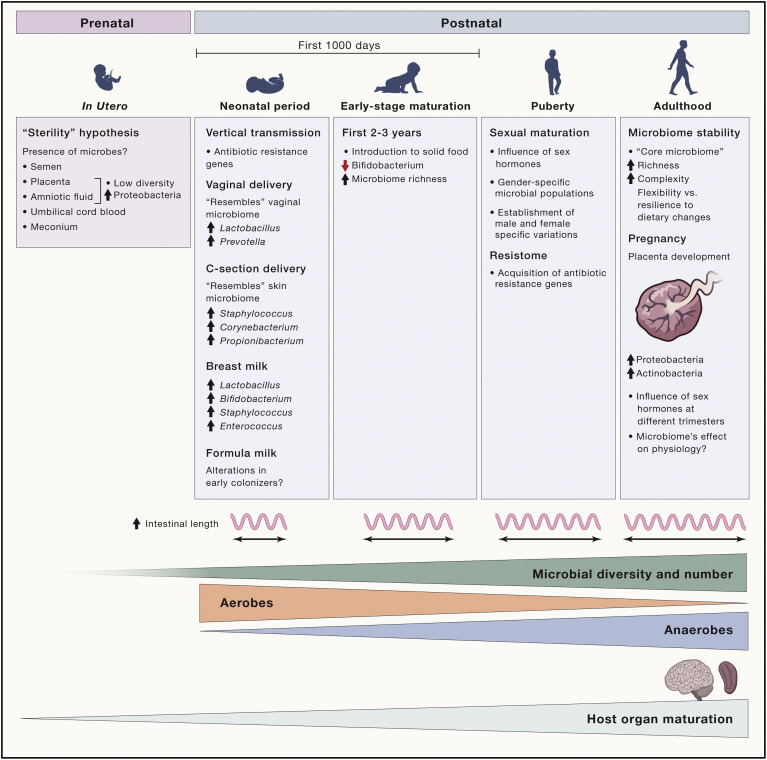
Figure 1 Changements du microbiome de l’enfance à l’âge adulte
La composition du microbiome intestinal change avec l’âge de l’hôte. Selon l’idée prédominante, l’embryon est stérile. Cependant, la présence de microbes dans le sperme, le placenta, le liquide amniotique, le sang de cordon ombilical et le méconium conteste cette hypothèse et suggère une colonisation du fœtus in utero. Le mode d’accouchement et le choix de l’alimentation (lait maternel ou lait maternisé) après la naissance influencent le processus de colonisation chez le nouveau-né. Avec l’âge, l’introduction à l’alimentation solide ajoute une complexité supplémentaire au microbiome immature et moins complexe. L’afflux d’hormones sexuelles associé à la puberté introduit des caractéristiques liées à la spécificité du microbiome existant. Enfin, chez les adultes, la richesse et la complexité du microbiome intestinal atteignent leur apogée avec la formation d’un « microbiome central » robuste qui ajoute de la flexibilité et réduit la vulnérabilité aux défis externes et internes. Ce processus de maturation du microbiome se déroule parallèlement au développement des organes hôtes, y compris l’intestin, qui s’allonge avec l’âge, fournissant des niches supplémentaires pour que le microbiome se développe en nombre et en diversité.
Une autre phase majeure de la transmission verticale du microbiome se produit pendant la naissance. Au moment de l’accouchement, les nouveau-nés sont souvent exposés à des microbes vaginaux dominés par Lactobacillus et Prevotella. En revanche, le microbiome des bébés nés par césarienne est dominé par Staphylococcus, Corynebacterium et Propionibacterium qui diffèrent de ceux de l’accouchement vaginal et ressemblent aux communautés microbiennes de la peau. Ce transfert d’espèces microbiennes de la mère à la progéniture est un point de contrôle important au début de la vie, car le nouveau-né est confronté à un changement métabolique massif lorsqu’il quitte l’environnement utérin, que le cordon est sectionné, qu’il initie sa propre respiration et commence activement à chercher de la nourriture.
D’autres sources de transmission postnatale sont le colostrum et le lait maternel. Certaines preuves indiquent que le colostrum et le lait maternel peuvent constituer des communautés de faible biomasse de bactéries symbiotiques et potentiellement probiotiques pour l’intestin du nourrisson, fournissant éventuellement jusqu’à 8 × 106 bactéries quotidiennement. Cette source d’inoculum microbien, associée à l’explosion unique et massive de lipides dans le lait maternel, augmente la diversité et la fonctionnalité du microbiome intestinal périnatal du nourrisson, comme en témoigne le passage du microbiome du méconium à un microbiome fécal beaucoup plus complexe au cours de la première semaine de vie. Curieusement, chaque mère semble héberger un motif microbien unique dans son lait maternel, suggérant une possible empreinte microbienne individualisée de la mère à l’enfant. Plusieurs rapports indiquent également une similitude entre les souches bactériennes dans ce transfert vertical initial de microbiomes de la mère à l’enfant, la plupart des microbes appartenant aux genres Lactobacillus, Staphylococcus, Enterococcus et Bifidobacterium (fig 1). En revanche, l’alimentation au lait maternisé peut modifier considérablement notre microbiote intestinal au cours de cette étape initiale de l’amorçage microbien au début de la vie en modifiant la composition des communautés microbiennes. La contribution relative de ces communautés microbiennes de faible biomasse associées au lait – et leur impact sur la physiologie et la maladie plus tard dans la vie – mérite d’être étudiée plus avant.
Maturation précoce
Le microbiome relativement simple acquis depuis la mère mûrit progressivement et acquiert une plus grande complexité lors de l’introduction du sevrage et de l’introduction des divers aliments d’un omnivore typique. En particulier, la dominance des bifidobactéries qui sont les mieux adaptées pour traiter les oligosaccharides du lait, diminue avec l’introduction d’aliments solides. Cette transition progressive du microbiome du nourrisson à un microbiome intestinal fonctionnellement plus mature coïncide avec un développement rapide du système immunitaire. On pense que cette transition prend jusqu’à trois ans, avec des changements maxima dans l’abondance relative des groupes taxonomiques. Un traitement antibiotique pendant cette période critique peut modifier cette phase de transition et la composition de ce microbiome infantile. Au cours de cette période, le microbiome infantile est caractérisé par la présence de gènes microbiens facilitant la dégradation des polysaccharides des plantes chez les nourrissons exclusivement nourris au lait, illustrant comment le microbiome peut acquérir des propriétés préparant son hôte à son changement anticipé vers un régime alimentaire d’origine végétale. Une vaste étude interculturelle a identifié des différences dans les voies bactériennes entre les bébés et les adultes, indépendamment de l’emplacement géographique. Par exemple, le microbiome des bébés est enrichi en gènes de biosynthèse de novo du folate, tandis que les adultes présentent un enrichissement en gènes impliqués dans le métabolisme du folate alimentaire dérivé de plantes. Curieusement, une plus grande variabilité des gènes fonctionnels interpersonnels parmi les microbiomes intestinaux des nourrissons par rapport aux adultes reflète que les signatures microbiennes acquises de la mère sont progressivement remplacées pendant la croissance du nourrisson dont le microbiote intestinal augmente en diversité et complexité. Une étude comparative longitudinale sur des paires de jumeaux malawiens de moins de 3 ans qui sont devenus discordants par le kwashiorkor a montré des signatures anormales chez les jumeaux atteints. Il est intéressant de noter que la transplantation du microbiote fécal des jumeaux malades a des souris a entraîné un perte de poids, ce qui suggère la pertinence causale des microbiomes intestinaux au début de la vie dans les maladies associées à la malnutrition, un problème de santé mondial.
Déjà à ce stade de développement, le microbiome intestinal du nourrisson peut influencer de nombreux organes et systèmes. L’axe « microbiome-intestin-cerveau » représente les interactions complexes entre l’intestin, son microbiote et le cerveau. Un composant essentiel de cet axe est le système nerveux entérique (SNE). En plus de contrôler directement la physiologie et le fonctionnement de l’intestin, tels que le péristaltisme, le flux sanguin intestinal et la sécrétion épithéliale, le SNE communique également de manière bidirectionnelle avec le système nerveux central (SNC) par transmission neuronale via les voies parasympathiques et sympathiques vagales. Un effet direct du microbiote intestinal sur le SNE a été démontré par la diminution des réseaux neuronaux entériques chez les animaux exempts de germes. Même si le microbiote intestinal du nourrisson est moins diversifié, il a un impact significatif sur le développement du SNE, comme l’a récemment montré la réduction des neurones myentériques chez les souris axéniques (exemptes de germes) au 3e jour postnatal par rapport aux souris normales. Les effets en aval de ces altérations développementales du microbiome sur le développement et la fonction du SNC de l’hôte méritent d’être étudiés plus avant, compte tenu de certaines corrélations suggérées entre les changements de composition du microbiome au début de la vie et les maladies neurologiques survenant plus tard dans la vie. Dans l’ensemble, il est évident que les 2 à 3 premières années de la vie humaine sont cruciales pour ce qui peut être considéré comme la maturation de base du microbiome, qui est façonné par des changements alimentaires majeurs et le développement du système immunitaire et influence peut-être le développement du SNC et du SNE et de leurs fonctions.
Puberté
L’adolescence et la puberté constituent une phase de la vie aux changements physiologiques majeurs liés à la maturation sexuelle et à un passage à l’âge adulte. Cette période de changements majeurs dans le développement est principalement due aux hormones et à une interaction intense entre les organes (cerveau, peau et organes génitaux). Par conséquent, cette période est captivante pour étudier les impacts hormonaux potentiels sur le microbiome intestinal. En effet, la diversification des microbiomes intestinaux spécifiques au sexe semble commencer au cours de cette période. Parallèlement, avec l’âge, on assiste à une réduction progressive de la population d’aérobies et d’anaérobies facultatifs, avec une augmentation simultanée du nombre d’anaérobies. Chez la souris, les microbiomes intestinaux presque identiques des mâles et des femelles au sevrage divergent selon le sexe pendant la puberté. Étonnamment, le transfert du microbiote intestinal des mâles adultes à des femelles immatures a modifié le microbiote de ces dernières, entraînant des niveaux élevés de libération de testostérone similaires à ceux des mâles et conférant une protection contre le diabète. Il reste à déterminer si un phénomène similaire existe chez l’homme et si les changements hormonaux survenant à la puberté déclenchent des changements dans le microbiome intestinal, ou inversement, si les changements dans le microbiome influencent certaines des caractéristiques de la maturation sexuelle, du comportement ou des schémas de sécrétion hormonale.
Contrairement aux rapports précédents, des études récentes suggèrent que les adolescents présentent un microbiome moins complexe et considérablement différent de celui des adultes, même s’ils partagent une configuration de base. En particulier, il a été observé que même si les adolescents présentent des niveaux significativement plus élevés de genres Clostridia et Bifidobacteria que ceux des adultes, le nombre d’espèces entre les deux groupes est similaire. De plus, le microbiome de l’adolescent diffère fonctionnellement de celui des adultes, exprimant des gènes liés au développement et à la croissance, tandis que le microbiome de l’adulte est davantage associé à l’inflammation et à l’obésité. Il est de plus en plus reconnu qu’au cours de la maturation de la petite enfance à l’adolescence, le microbiome acquiert un répertoire de gènes de résistance aux antibiotiques appelé « résistome ». Il nous reste à savoir si la présence de ces gènes de résistance aux antibiotiques dans le microbiome en début de vie influence la coexistence hôte-microbiome. L’adolescence marque le début de plusieurs troubles de l’humeur, comme l’anxiété, la dépression, la schizophrénie et les troubles de l’alimentation. En parallèle, des processus clés de développement, tels que l’élagage synaptique (un réglage fin progressif du cerveau obtenu par l’effacement des synapses et une augmentation de la myélinisation, en particulier dans le cortex frontal) sont atteints à l’adolescence. La question de savoir si les variations du microbiome ont un impact sur ces processus dans ce groupe d’âge mérite une étude plus approfondie.
Âge adulte
Le microbiote adulte est relativement plus stable que celui des premiers âges, probablement en raison du développement de ce qui ressemble à une communauté centrale de colonisateurs permanents qui atténuent les agressions exogènes comme le stress et l’exposition aux antibiotiques et aident à restaurer la configuration microbienne d’origine. Ainsi, il semble qu’un microbiome intestinal de base existe au niveau fonctionnel chez les adultes en bonne santé, malgré le niveau élevé de variation individuelle. L’augmentation de la richesse et de la complexité microbiennes, une caractéristique du microbiome adulte, est conforme à l’expansion progressive de la surface intestinale avec les années, avec un pic à l’âge adulte, créant ainsi des niches distinctes supplémentaires pour le recrutement de nouveaux symbiotes (fig 1). Bien que le microbiome adulte soit assez stable, il peut encore être sensible aux changements causés par les perturbations environnementales. Une étude récente montre que même une exposition à court terme à un régime alimentaire à base de plantes ou d’animaux peut modifier considérablement la structure de la communauté microbienne intestinale adulte, ce qui indique l’énorme souplesse du microbiome pour évoluer sur le plan fonctionnel. D’autres études portant sur des interventions nutritionnelles humaines à court terme remettent en question cette notion et offrent une vision du microbiome plus résiliente face à ces régimes. De plus, il a également été suggéré que les changements environnementaux, comme les variations saisonnières ou les fluctuations de température, influencent le microbiote intestinal des animaux en modifiant leur composition et leur fonction. Ainsi, les différences observées dans le microbiote intestinal des adultes vivant sous d’autres latitudes sont vraisemblablement le résultat de multiples facteurs environnementaux spécifiques à une région qui façonnent la composition et la fonction du microbiome intestinal. La haute altitude a également été impliquée comme facteur dans la modulation de la configuration du microbiome. Un rapport récent suggère que les microbiomes des ruminants de haute altitude ont évolué pour améliorer les apports énergétiques dans ces environnements extrêmes. Il est possible que la disponibilité réduite de l’oxygène en haute altitude puisse être un autre contributeur dans la régulation de la dynamique du microbiome intestinal chez l’hôte.
Au cours de la grossesse, une altération majeure de la composition du microbiome intestinal se produit particulièrement au troisième trimestre avec un augmentation des espèces de protéobactéries et d’actinobactéries. La transplantation de microbiome de mères du troisième trimestre à des souris exemptes de germes a induit des changements métaboliques tels qu’une augmentation du gain de poids corporel et des réponses inflammatoires par rapport aux receveurs transplantés avec du microbiote de mères du premier trimestre. Il convient de noter qu’une étude de suivi n’a toutefois pas permis de détecter de changements majeurs dans le microbiome intestinal aux différents trimestres de la grossesse. Il est néanmoins tentant de supposer que les modifications de la composition du microbiome intestinal, ainsi que les changements spectaculaires de la dynamique hormonale pendant la grossesse et les premières périodes post-partum, peuvent affecter l’équilibre psychiatrique et le bien-être des mères et, dans certains cas, les prédisposer à développer des problèmes psychiatriques comme l’anxiété et la dépression. Il reste à déterminer si ces fluctuations hormonales et microbiennes pendant la grossesse ont un impact sur l’homéostasie psychiatrique des mères plus tard dans la vie.
Vieillissement
Au fur et à mesure que les humains vieillissent, ils développent universellement une perte progressive de fonction dans plusieurs systèmes impliqués dans la croissance, le métabolisme, l’homéostasie énergétique et l’immunité. Plusieurs études ont tenté d’examiner les changements liés au vieillissement dans la dynamique du microbiome intestinal en comparant la composition du microbiome des nourrissons et des adultes à celle des personnes âgées et des centenaires. L’une des études pionnières dans ce domaine, qui a caractérisé les profils microbiotiques de 161 personnes âgées de race blanche, a révélé un changement spectaculaire des Firmicutes, qui dominent le microbiome intestinal des jeunes adultes, vers les Bactériodètes chez les personnes âgées de plus de 65 ans. En fait, le microbiome de base était significativement différent entre les humains âgés et les jeunes humains. Les genres Bacteroides, Alistipes et Parabacteroides, qui représentaient plus de la moitié du microbiome de base des personnes âgées, ne représentaient que 8 à 27 % du noyau de microbiome chez les plus jeunes. Il est intéressant de noter qu’une forte variabilité interindividuelle a été observée dans le microbiome intestinal des personnes âgées, avec des fluctuations maximales chez Faecalibacterium et Ruminococcus. Certains amas de Clostridium, en particulier IV et XIVa, étaient également très variables dans leurs proportions. De plus, l’échantillonnage du microbiome en fonction du temps chez les mêmes individus a révélé que la variabilité interindividuelle était beaucoup plus importante que les variations intra-individuelles avec le temps. Cependant, la période d’étude de 3 mois choisie pour surveiller les variations intra-individuelles n’a peut-être pas été suffisante pour saisir les changements communautaires majeurs.
Les liens entre le microbiome et le déclin de santé lié à l’âge sont influencés par le statut de résidence, le mode de vie et l’alimentation, puisque les microbiomes des personnes âgées vivant dans des établissements de soins de longue durée portent une signature distincte de celles des personnes âgées vivant dans les communautés usuelles où résident des jeunes (fig 2). Les bactériodètes dominent dans les EHPAD, tandis que les firmicutes dominent chez les vieillards socialement insérés. Coprococcus et Roseburia étaient les genres les plus abondants chez les vieillards insérés tandis que Coprobacillus, Anaerotruncus, Parabacteroides, Lactonifactor et Eubacterium caractérisent le microbiome des individus résidant en EHPAD. L’analyse des correspondances décrivant la variance du microbiome en fonction de la consommation alimentaire entre les groupes de personnes âgées insérées et les personnes âgées en EHPAD a permis de définir quatre groupes en fonction de leur rapport de consommation de fibres et graisses. En général, les sujets insérés socialement consommaient une alimentation plus riche en fibres, ce qui était corrélé à un microbiome plus diversifié et à un état inflammatoire réduit. Bien que cette étude ait été réalisée sur un nombre relativement restreint d’individus et n’ait pas confirmé que les composants du microbiome présentaient des effets causaux sur le vieillissement en bonne santé, le séquençage métagénomique a révélé un enrichissement en gènes bactériens associés au métabolisme des acides gras à chaîne courte (en particulier l’acétate et le butyrate) dans le microbiome des personnes insérées par rapport aux résidants en EHPAD, suggérant ainsi une association entre les caractéristiques du microbiome de ces derniers et les paramètres de santé, tels que l’indépendance fonctionnelle, l’indice de Barthel et la nutrition, la pression artérielle et la circonférence du mollet, indiquant une fragilité globale (fig 2). Ces associations intéressantes méritent de futures études.
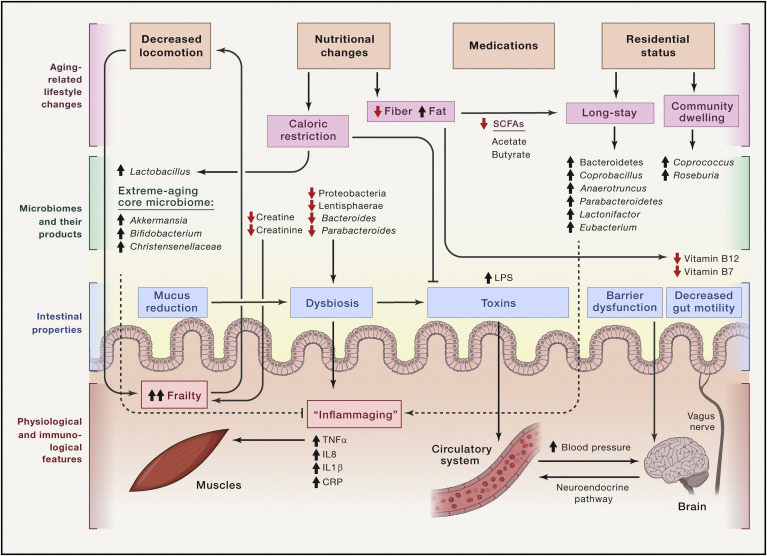
Figure 2 : Le microbiome intestinal dans le vieillissement
Le vieillissement s'accompagne de changements importants dans le mode de vie, tels qu'une diminution de la locomotion, des changements nutritionnels, une consommation chronique de médicaments et, dans certains cas, un changement de statut résidentiel. Il reste à déterminer si ces facteurs entraînent des changements du microbiome qui favorisent davantage la détérioration liée au vieillissement ou si le microbiome personnalisé lui-même dicte certaines des réponses physiologiques à cet environnement changeant. L'expansion générale des phylums Bacteriodetes aux dépens des phylums Firmicutes a été observée chez les individus de plus de 65 ans, en particulier la richesse réduite des phylums Proteobacteria et Lentisphaerae et des genres Bacteroides et Parabacteroides. Les métabolites associés au microbiome, tels que les vitamines B7 et B12, la créatine et la créatinine, et leurs voies de biosynthèse, diminuent avec le vieillissement, contribuant à l'atrophie musculaire et à la fragilité. Les microbiomes des personnes vivant dans des établissements de soins de longue durée sont significativement différents de ceux des personnes âgées vivant dans la communauté, très probablement en raison de régimes nutritionnels plus riches en fibres dans le groupe vivant dans la communauté, ce qui est confirmé par des gènes de synthèse d'acides gras à chaîne courte (AGCC) enrichis dans ce groupe. En revanche, un régime pauvre en fibres est corrélé à un état inflammatoire et à une fragilité accrus. Chez la souris, la restriction calorique est corrélée négativement aux taux sanguins de LPS et à la fragilité et elle est corrélée positivement aux taux de Lactobacillus.
Chez les supercentenaires, un microbiome central enrichi en Bifidobacteria, Christensenellaceae et Akkermansia associés à la santé a été identifié. Le changement substantiel du microbiome avec le vieillissement peut affecter les changements dans la physiologie intestinale tels qu'une contractilité intestinale réduite, une sécrétion de mucus diminuée, un dysfonctionnement de la barrière intestinale et une dysbiose consécutive. Ces changements peuvent favoriser davantage la translocation des toxines et des métabolites bactériens dans la circulation sanguine et affecter la fonction cérébrale par des voies circulatoires, immunitaires, hormonales ou par une transmission neuronale directe via les afférences du nerf vague.
La recherche sur le vieillissement dans de petits modèles animaux a identifié des changements distincts du microbiome, en particulier chez les souris âgées, qui ressemblent partiellement aux changements du microbiome observés chez les humains âgés. Bien que l’expansion significative du genre Alistipes observée chez les souris d’âge moyen et âgées ait également été documentée chez l’homme, une corrélation négative entre l’abondance de Faecalibacterium et de Lactobacillus et la fragilité a été observée chez l’homme, mais pas chez la souris. Contrairement à certaines études chez l’homme, les microbiomes des souris âgées ne présentaient aucune représentation des membres de la famille des Eubacteriaceae, et aucune différence n’a été observée dans les rapports Firmicutes / Bacteroidetes. Cependant, il existe certaines similitudes entre les microbiomes humains et murins âgés, par exemple, de faibles niveaux de métabolites associés au microbiome, la cobalamine (vitamine B12) et la biotine (vitamine B7), et leurs voies métaboliques microbiennes respectives. En revanche, la dégradation de la créatine et de la créatinine s’élève avec l’âge, en corrélation avec l’atrophie musculaire et la fragilité, comme chez l’homme (Figure 2). Chez la souris, certaines études ont rapporté une diminution des Lactobacillus avec l’âge, qui n’a pas été retrouvée dans d’autres études. Il est intéressant de noter que le genre Akkermansia, qui est associé à des effets bénéfiques dans certaines maladies chez la souris et l’homme, a considérablement diminué chez les souris d’âge moyen et a presque complètement disparu chez les souris âgées. Étant donné qu’Akkermansia est impliqué dans le remodelage intestinal et l’autophagie et qu’il contrôle la capacité d’absorption intestinale via le maintien de la dynamique Bacteroidetes/Firmicutes, sa disparition avec l’âge mérite d’être mieux étudiée. Les changements liés à l’âge dans le microbiome de la souris peuvent provenir de différences environnementales, principalement de facteurs alimentaires. Par exemple, une longue restriction calorique de 30% chez les souris nourries avec un régime pauvre en graisses enrichit les communautés de Lactobacillus avec le vieillissement et est associée à une durée de vie prolongée et à une réduction des taux sériques de lipopolysaccharides (LPS). Au contraire, la plupart des espèces de microbiome chez les souris soumises à un tel régime sont nettement différentes et appartenaient à la famille des Porphyromonadaceae. Contrairement aux effets des habitudes alimentaires ou du statut résidentiel sur la composition du microbiome chez les personnes âgées, le rôle des facteurs intrinsèques de l’hôte dans ce processus reste moins étudié. L’étude des microbiomes de souris jeunes, d’âge moyen et âgées ont noté des différences significatives en fonction de l’âge dans leurs microbiomes malgré la similitude génétique de ces cohortes. Cela suggère que les signaux intrinsèques de l’hôte vieillissant peuvent moduler la composition, la fonction et la richesse du microbiome. Cependant, les facteurs de confusion liés à l’élevage doivent être exclus.
La ménopause et son impact sur le niveau d’estrogènes, donc sur la croissance et les fonctions musculaires et osseuses, pourrait aussi avoir un impact sur la configuration du microbiome. Des études récentes de greffe de microbiome sur des souris suggèrent que le microbiome de souris plus âgées agit plus significativement sur l’hippocampe. Le rôle du microbiote sur la croissance d’organes métaboliquement actifs comme l’intestin mérite des études sur le rôle possible dans les cancers liés à l’âge.
Notre cerveau est également soumis à des changements indésirables liés à l’âge, comme un développement altéré au début de la vie ou une neurodégénérescence accélérée plus tard dans la vie. Curieusement, les associations cliniques entre certains troubles neurodégénératifs et les troubles gastro-intestinaux, y compris les troubles du spectre autistique, la maladie de Parkinson et la maladie d’Alzheimer, ont suscité l’intérêt pour l’exploration de liens possibles entre les perturbations du microbiome et les manifestations de ces troubles. En effet, des associations microbiome-SNC dans des modèles animaux ont été mises en évidence pour ces trois maladies. Des études préliminaires chez l’homme suggèrent que la maladie de Parkinson est associée à des altérations de la composition du microbiome intestinal, en particulier dans le genre Prevotella et les entérobactéries. Plusieurs types et voies cellulaires peuvent intervenir dans cet axe « microbiome intestinal-système nerveux central » (Figure 3). Collectivement, ces associations intéressantes soulignent l’importance et la nécessité d’approfondir l’étude des mécanismes qui orchestrent l’axe microbiome - système nerveux intestinal afin d’élargir les connaissances nécessaires pour déchiffrer la composante environnementale des neuropathologies.
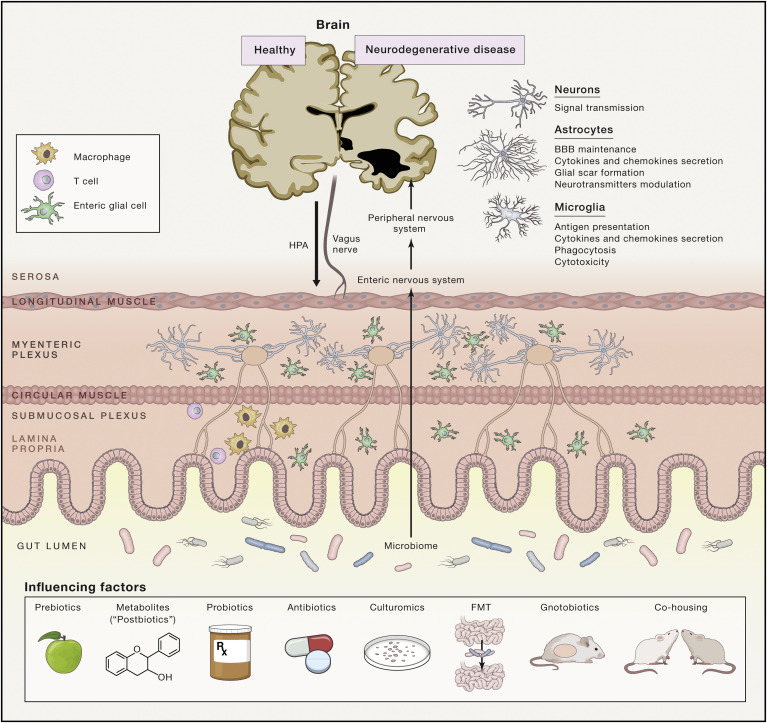
Figure 3 : La diaphonie bidirectionnelle entre le microbiome, l’intestin et le système nerveux et les moyens possibles de la manipuler
Le dialogue entre le microbiome intestinal et le système nerveux central (SNC) est un réseau complexe d'interactions qui commence seulement à être compris. Les molécules associées aux microbes sont constamment détectées par les cellules immunitaires (par exemple, les macrophages et les cellules dendritiques) et les cellules gliales entériques (EGC) dans la lamina propria qui peuvent en outre sécréter des molécules de signalisation neuromodulatrices, affectant les nerfs entériques dans les plexus sous-muqueux et myentériques. Le cerveau et la moelle épinière peuvent être affectés par la réponse des nerfs entériques ou par ces signaux associés aux microbes directement à partir de la transmission vagale ou par la circulation systémique à travers le plexus choroïde dans les ventricules du cerveau. Dans le SNC, différents types de cellules, tels que les neurones, la microglie et les astrocytes, peuvent répondre à ces signaux en modifiant leur programme transcriptionnel d'une manière qui soutient ou inhibe les conditions pathologiques. La phagocytose des plaques bêta-amyloïdes pathogènes (Aβ), l'élévation des enzymes de dégradation de l'Aβ et la sécrétion d’oxyde nitrique (NO) et de cytokines et chimiokines inflammatoires dans la maladie d'Alzheimer sont des exemples possibles de telles réponses cellulaires. Un arsenal accru de paradigmes de recherche évolue pour aider à décortiquer les mécanismes sous-jacents à l'axe microbiome-intestin-cerveau dans les neuropathologies. Ces paradigmes comprennent l'utilisation continue d'antibiotiques chroniques et de modèles animaux sans germes pour les maladies neurologiques ; la transplantation de microbiome fécal de patients humains ou de modèles animaux dans des animaux traités aux antibiotiques ou sans germes ; le co-hébergement de modèles animaux avec des témoins naïfs ou spécifiquement colonisés ; le traitement avec des pré-, pro- ou postbiotiques pour coloniser l'intestin avec une microbiome selon son choix ; et l'application de nouvelles méthodes de culture pour isoler les souches bactériennes potentiellement pertinentes pour la maladie .
Vieillissement extrême : les centenaires
Une approche intéressante visant à comprendre les rôles potentiels du microbiome intestinal dans le vieillissement et la longévité implique l’exploration du microbiome de personnes extrêmement âgées. Des études explorant le microbiome aux extrêmes de la durée de vie humaine ont souligné que les différences dans la composition du microbiome intestinal entre les jeunes adultes et les sujets âgés (séparés d’environ 40 ans) sont plus faibles que les différences observées entre les personnes âgées et les centenaires, séparés par moins de 30 ans de vie. L’une des découvertes les plus frappantes a été l’émergence d’une empreinte microbienne unique chez les centenaires, caractérisée par une abondance accrue de taxons « associés à la santé » comme Bifidobacterium, Christensenellaceae et Akkermansia (Figure 2). Bien que la démonstration de la causalité de ces microbiomes « bénéfiques » n’ait pas encore été réalisée, elle offre un aperçu fascinant d’une possible empreinte biologique qui pourrait être utilisée pour explorer des ensembles de communautés et de fonctions microbiennes favorisant le vieillissement.
Impact du microbiome sur la durée de vie
La contribution du microbiome intestinal à la durée de vie humaine n’a pas été étudiée à ce jour. Cependant, plusieurs études portant sur des formes de vie plus simples et récemment sur des modèles animaux sont un début pour explorer la façon dont les génomes des méta-organismes peuvent interagir pour influencer la longévité de l’hôte. Des modèles d’invertébrés tels que la mouche des fruits Drosophila melanogaster et le nématode Caenorhabditis elegans ont été utilisés comme modèles pour étudier l’axe microbiome-vieillissement, car ils hébergent un microbiote à la fois dans la nature et en laboratoire. De telles études ont produit des observations intéressantes sur les interactions dépendantes de l’âge entre C. elegans et des bactéries commensales spécifiques de ce ver et sur la façon dont elles peuvent avoir un impact significatif sur sa durée de vie. Par exemple, la bactérie E. coli OP50 et Comamonas DA1877 ont montré qu’ils induisaient des réponses métaboliques différentielles chez le ver, modulant le développement et le vieillissement. Une étude récente a mis en évidence le rôle de l’oxyde nitrique (NO), produit exclusivement par les bactéries commensales productrices de NO, dans la régulation de la longévité des vers. Récemment, deux autres études ont démontré que le médicament antidiabétique metformine, déjà avéré comme un puissant facteur de longévité de C. elegans, agit sur les voies métaboliques du folate de la bactérie commensale de ce ver, entraînant une réduction de la teneur en méthionine de son microbiote et améliore sa longévité. Il est intéressant de noter qu’on a récemment découvert un ensemble de 29 gènes d’E. coli qui, lorsqu’ils étaient supprimés, augmentaient considérablement la vie de C. elegans, suggérant un lien microbien robuste avec la longévité chez des organismes plus complexes. Une étude met en évidence un mécanisme unique où l’acide colanique, un polysaccharide bactérien, favorise l’augmentation de la durée de vie des vers en modulant la dynamique mitochondriale et la réponse protéique chez l’hôte.
Plusieurs études récentes ont mis en évidence de possibles effets régulateurs du microbiote sur le vieillissement des mouches D. melanogaster. Une voie de signalisation liée au vieillissement récemment découverte dans la couche épithéliale intestinale de la mouche a été reconnue comme étant régulée par le facteur de transcription Foxo, qui réduit un capteur immunitaire inné en aval nommé SC2. Il a été démontré que l’altération de la signalisation par cette voie entraîne des altérations de la composition et de la fonctionnalité du microbiote des mouches, une perturbation de l’intégrité épithéliale et une réduction de la durée de vie des mouches. La restauration de cette voie a amélioré la longévité, suggérant que le microbiote et ses effets sur les programmes transcriptionnels de l’hôte peuvent agir comme des facteurs de longévité. Chez les larves de drosophile, la croissance sous un régime pauvre en nutriments a entraîné un retard de croissance secondaire à l’activité du microbiote des mouches, en particulier de la souche Lactobacillus plantarum, qui induit une régulation positive de la voie TOR de l’hôte. Étant donné que la suppression de TOR est liée à une longévité accrue chez toutes les espèces, il sera intéressant de déterminer si les membres du microbiote tels que L. plantarum peuvent réguler le vieillissement, en plus de ses effets notés sur la croissance. La question de savoir si ces rôles intéressants du microbiome ont également un impact sur des formes de vie plus complexes, y compris les humains, et si de tels mécanismes de longévité présumés pourraient être manipulés reste insaisissable et mérite des études plus approfondies. Notamment, une association intéressante récente entre le microbiome et l’inflammation liée à l’âge a été décrite dans un modèle de mammifère. Il a été démontré que les souris axéniques vivent plus longtemps que les souris conventionnelles et présentent des niveaux réduits de cytokines pro-inflammatoires circulatoires. Le co-habitat de souris axéniques avec des animaux conventionnels âgés, mais pas avec de jeunes animaux conventionnels, a entraîné une augmentation de l’état inflammatoire. Il a été suggéré que l’effet du microbiome dépendant du vieillissement sur l’inflammation est médié par le TNF-α. Un traitement anti-TNF-α chez des souris a aboli l’inflammation associée à l’âge. L’éphémère killifish turquoise africain (Nothobranchius furzeri) est de plus en plus utilisé et semble être un modèle attrayant pour étudier le vieillissement. Fait intéressant, la transplantation de microbiome de jeunes poissons à des plus âgés a entraîné une augmentation de la durée de vie, un retard des caractéristiques comportementales liées au vieillissement et une plus grande diversité microbienne.
Conclusions et perspectives
La dynamique du microbiome
Dans de multiples études d’association, le microbiome intestinal semble présenter des caractéristiques particulières à chaque phase de la vie. À partir d’une composition microbienne relativement simple, qui semble être influencée par le mode d’accouchement à la naissance, la progéniture grandit avec une complexité accrue du microbiome associée à des influences environnementales et physiologiques, telles que la nutrition, le mode de vie, les changements hormonaux, l’immunité et éventuellement l’interaction entre le microbiome, l’intestin et le cerveau. Bien qu’il soit considéré comme flexible et influencé par des signaux environnementaux, la composition et la fonction du microbiome sont probablement dominées par un microbiome central à variation lente et transmis verticalement, associé à un composant microbien plus flexible qui répond plus rapidement à la dynamique environnementale. Les sociétés microbiennes et les fonctions humaines semblent varier considérablement, en partie en raison de l’emplacement géographique et de l’apport alimentaire. Ces variabilités peuvent être utilisées dans le cadre de la médecine personnalisée, dans laquelle les microbes spécifiques au patient ou à la maladie et/ou leurs métabolites seraient exploités cliniquement pour le diagnostic et les traitements. Bien que de nombreux progrès aient été réalisés dans la caractérisation des signatures microbiennes associées aux différentes étapes de la vie, des recherches supplémentaires doivent être menées pour déterminer si et quels composants du microbiome confèrent des effets sur l’holobionte. Raisonnablement, il existe un besoin imminent d’inclure des études fonctionnelles dans la recherche sur le microbiome impliquant la transcriptomique afin de mieux comprendre l’interaction complexe entre les microbes et leur hôte. Il nous manque actuellement des études prospectives sur les changements microbiens au sein d’un même individu tout au long de sa vie. À l’heure actuelle, la plupart des études liées à l’âge restent à un niveau descriptif, rapportant des changements de composition microbienne entre différents groupes d’âge, alors qu’à notre connaissance, il n’existe aucune étude présentant une relation causale entre les phénotypes dépendants de l’âge et un microbiome spécifique et/ou leurs produits. Par exemple, il serait impératif d’examiner le processus de vieillissement de souris axéniques colonisées par des microbiomes d’individus d’âges différents. D’autres limites découlent de l’utilisation fréquente du séquençage de l’ADNr 16S comme moyen de caractérisation du microbiome, qui permet d’identifier la plupart des bactéries jusqu’au niveau du genre. L’utilisation du séquençage métagénomique pourrait permettre d’identifier des souches bactériennes spécifiques liées au vieillissement ou affectées, qui pourraient ensuite être cultivées (si possible) et étudiées en profondeur à l’aide d’animaux axéniques et de modèles animaux transgéniques porteurs de maladies dépendantes de l’âge. Les approches métatranscriptomiques pourraient aider à identifier des voies microbiennes spécifiques impliquées dans le processus de vieillissement et les troubles liés à l’âge. Cette approche intégrative permettrait potentiellement de décrypter les mécanismes par lesquels le microbiome est affecté et/ou affecte activement la maturation et le vieillissement.
Les observations récentes intéressantes, mettant en évidence la colonisation possible de communautés microbiennes à faible biomasse dans les tissus et les organes, comme la graisse, la vessie, la vésicule biliaire et le placenta, soulèvent la possibilité d’étudier les rôles fonctionnels qu’ils peuvent jouer dans l’homéostasie ou la perturbation des organes. À cet égard, un exemple élégant a récemment démontré comment le simple fait de modifier les conditions expérimentales peut avoir un impact sur les conclusions tirées sur les effets du microbiome sur la physiologie de l’hôte. Par exemple, le méthane est nécessaire pour permettre aux microbes de pénétrer dans les cellules eucaryotes des palourdes des grands fonds. Cependant, l’hébergement de ces palourdes en laboratoire en l’absence de méthane leur permet d’échapper aux microbes, ce qui entraîne une altération de leur physiologie. Cela suggère que la colonisation microbienne de tissus apparemment stériles de faible biomasse peut avoir un impact sur leurs fonctions, mais que leur étude peut nécessiter des conditions environnementales distinctes qui peuvent passer inaperçues en laboratoire.
Enfin, il devient clair que les micro-organismes, comme les humains, vivent dans des communautés qui, dans certains cas, forment des structures de biofilm distinctes. Les réseaux de communication in vivo qui sous-tendent ces sociétés microbiennes hautement structurées et leurs impacts sur l’hôte sont peu étudiés dans le cadre du microbiome in vivo et méritent d’être explorés plus avant.
Stratégies émergentes d’intervention sur le microbiome humain
Les traitements ciblant le microbiome sont considérés comme des modalités futures potentiellement attrayantes, car les microbes intestinaux sont relativement accessibles aux interventions par voie orale et car le microbiome – contrairement au génome humain – peut être potentiellement susceptible d’être modifié par de telles interventions. Cependant, les interventions fiables et reproductibles ciblant spécifiquement les microbes d’intérêt sont actuellement limitées. La greffe de microbiote fécal à partir de donneurs testés semble particulièrement prometteuse pour les patients atteints d’entérocolite à Clostridium difficile, mais son efficacité dans les troubles liés à l’âge n’a pas encore été testée. Les probiotiques sont une autre intervention de ce type, mais leur efficacité de colonisation et leurs effets sur l’hôte en aval restent controversés. Un exemple provocateur et spéculatif, des probiotiques nommé « psychobiotiques » sont testé pour induire des effets psychotropes. Selon des rapports récents, l’administration d’espèces microbiennes spécifiques peut avoir un impact sur la fonction cérébrale soit en modulant les niveaux et la disponibilité des neurotransmetteurs, tels que la sérotonine, le glutamate et l’acide γ-aminobutyrique, soit en affectant les fonctions immunologiques ou les signaux hormonaux (par exemple, les réponses médiées par les glucocorticoïdes) de l’axe hypothalamo-hypophyso-surrénalien. Nonobstant ces observations, des recherches mécanistes sont nécessaires pour déterminer l’efficacité et la stabilité de la colonisation, les mécanismes moléculaires d’action, les interactions combinatoires et les interactions croisées entre les bactéries administrées, les commensaux endogènes et leurs effets sur l’hôte. D’autres modalités de modulation du microbiome actuellement explorées comprennent l’intégration de produits bactériens personnalisés (postbiotiques), la modulation rationnelle du microbiome par des prébiotiques ou par une nutrition personnalisée (Figure 3), et une perturbation microbienne ciblée par phagothérapie. Collectivement, ces modalités pourraient servir de futurs moyens de moduler le microbiome de manière contrôlée, ce qui pourrait avoir un impact sur les troubles associés. La prise de conscience que le microbiote intestinal influence la physiologie humaine représente un changement de paradigme dans la médecine moderne et marque une avancée conceptuelle phénoménale dans notre compréhension de la biologie moderne et de l’évolution humaine. Une compréhension détaillée de notre microbiome intestinal insaisissable et évolutif, qui possède la capacité de répondre et de s’adapter continuellement aux fluctuations intrinsèques et environnementales, comme l’âge, l’alimentation et le stress, offrira une occasion fantastique de soutenir la médecine du XXIe siècle dans sa tentative de développer des régimes d’intervention pour promouvoir la santé humaine.
Bibliographie
Kundu P, Blacher E, Elinav E, Pettersson S
Our Gut Microbiome: The Evolving Inner Self
Cell. 2017 Dec 14;171(7):1481-1493
DOI : 10.1016/j.cell.2017.11.024
Et pour aller plus loin
Profil de nos 5000 abonnés
| Par catégorie professionnelle | |
| Médecins | 27% |
| Professions de santé | 33% |
| Sciences de la vie et de la terre | 8% |
| Sciences humaines et sociales | 12% |
| Autres sciences et techniques | 4% |
| Administration, services et tertiaires | 11% |
| Economie, commerce, industrie | 1% |
| Médias et communication | 3% |
| Art et artisanat | 1% |
| Par tranches d'âge | |
| Plus de 70 ans | 14% |
| de 50 à 70 ans | 53% |
| de 30 à 50 ans | 29% |
| moins de 30 ans | 4% |
| Par motivation | |
| Patients | 5% |
| Proche ou association de patients | 3% |
| Thèse ou études en cours | 4% |
| Intérêt professionnel | 65% |
| Simple curiosité | 23% |
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
La biologie évolutionniste peut nous aider à relever de grands défis - Les différences entre espèces dans leur capacité à s’adapter aux changements environnementaux [...]
Avantages éventuels du régime paléolithique - Il y a 3 millions d’années, nos ancêtres du Paléolithique mangeaient plus de protéines que [...]
Le cerveau détecte la maladie des autres - Le cerveau détecte la maladie chez les autres avant même qu'elle n'éclate Résumé Selon [...]
Environnement de la grossesse, épigénétique et sensibilité aux maladies - Il existe désormais de nombreuses preuves épidémiologiques entre les expositions [...]
Césariennes, flore intestinale et obésité. - Médecins et épidémiologistes avaient constaté depuis longtemps que la naissance par césarienne [...]
Vous aimerez aussi ces humeurs...
Les mâles et l'accouchement - Les femmes ont été les seules gestionnaires des accouchements jusqu’au milieu du XVIII° [...]
Critères de Hill - L’étude de Doll et Hill en 1950 a établi le lien entre le tabac et le cancer du poumon. Les [...]
L'âge n'est pas un facteur de risque - Comme leur nom l’indique, les « facteurs de risque » sont les facteurs qui augmentent la [...]
Légalisation du cannabis - Deux thèmes tissent les débats sur la dépénalisation du cannabis, d’une part la nocivité [...]
Trump et Musk : un diagnostic trop facile - Les diagnostics psychiatriques sont les plus difficiles de tous. La psychiatrie est un domaine [...]
La phrase biomédicale aléatoire
Une erreur peut être vraie ou fausse, selon que celui qui l’a commise, s’est trompé ou non.
― Alphonse Allais
Vous aimerez aussi ces humeurs...
Statistiques vulgaires - Si vous affirmez qu’une seule année de tabagisme diminue la durée de vie de deux mois en [...]
Djihadisme ou psychotropes - Après chaque tuerie barbare, se pose l’inévitable question de son lien avec le terrorisme [...]
Le retour du pathognomonique - Quand nous étions étudiants ou jeunes médecins, les signes pathognomoniques étaient un [...]
Prolactine, testostérone et viagra - Le saviez-vous ? Tout homme, quel que soit son âge, mis en présence d’un [...]
L’apogée médicale serait déjà loin - Le succès médical de l’insuline en 1921 s’est accompagné d’un succès commercial [...]
Sciences de l'évolution, génétique et biologie moléculaire
• Biologie : La biologie évolutionniste devant les nouveaux grands défis • Biologie [...]
