Procréation médicalement assistée : anomalies épigénétiques
dernière mise à jour le 13/02/2021
L’aide médicale à la procréation induit-elle des anomalies épigénétiques ?
L’assistance médicale à la procréation (AMP) incluant FIV, ICSI, cryoconservation des embryons, transfert précoce ou tardif, a profondément transformé le traitement de l’infertilité et compte maintenant pour environ 2 % des naissances dans les « pays industrialisés ». Jusqu’à récemment, les études de suivi des enfants nés d’AMP n’avaient pas mis en évidence d’augmentation significative du risque de malformations congénitales par rapport à la population générale.
Les études plus récentes suggèrent que l’AMP pourrait être responsable d’anomalies, notamment de la croissance fœtale. Ces pathologies impliquant des anomalies épigénétiques – et plus particulièrement de l’empreinte parentale – ont été rapportées chez les animaux ou les humains concernés par ces techniques d’aide médicale à la procréation. Cela inclut les syndromes de croissance excessive chez les ovins et les bovins : large offspring syndrome(LOS), et chez les humains les syndromes de Beckwith-Wiedemann (BWS) et d’Angelman (AS), mais aussi dernièrement les retards de croissances intra-utérins (RCIU) et plus particulièrement les patients présentant un syndrome de Silver Russell (SRS). Dans les désordres de l’empreinte parentale décrits après AMP, l’épimutation implique toujours une perte de méthylation, qu’il s’agisse de l’allèle maternel ou paternel. Enfin, si chez la majorité des patients, l’atteinte épigénétique est localisée à un seul locus soumis à empreinte, certains patients présentent des anomalies sur plusieurs loci. Comme la mise en place ou le maintien de l’empreinte génomique se situe lors de deux périodes critiques – la gamétogenèse et le développement précoce préimplantatoire du zygote –, ces données suggèrent que les procédures d’AMP pourraient interférer avec les mécanismes épigénétiques de l’empreinte génomique. Des études prospectives et à long terme de larges cohortes d’enfants nés après AMP sont donc nécessaires pour évaluer clairement ces risques. Le code génétique d’une cellule ES, d’une cellule cardiaque, d’une cellule rénale... est le même et pourtant elles expriment des gènes différents selon leur différenciation ; cela est dû à une régulation épigénétique qui se surimpose au code génétique.
L’épigénétique
La régulation de l’expression des gènes n’est pas contrôlée uniquement par le code génétique mais aussi par des modifications épigénétiques.
L’empreinte parentale est une modification épigénétique particulière, car elle touche un seul des 2 allèles et induit une différence de fonction entre les 2 allèles de séquence nucléotidique identique. Le contrôle épigénétique est représenté par l’ensemble des modifications non contenues dans la séquence nucléotidique de l’ADN (code génétique), mais qui sont cependant héritables, c’est-à-dire transmissibles lors de la mitose, et qui contrôlent l’expression des gènes. L’unité de base de l’organisation chromatinienne est représentée par le nucléosome constitué d’un octamère de protéines histones autour duquel s’enroule le brin d’ADN (figure 1). La marque épigénétique la mieux connue est la méthylation de l’ADN au niveau d’îlots CpG (domaines d’ADN très riches en dinucléotides CG). Les modifications post-traductionnelles (acétylation, méthylation, etc.) des histones H3 et H4 ont aussi un rôle déterminant dans la régulation épigénétique. Au niveau d’une région chromatinienne, les différentes modifications post-traductionnelles des histones (code histone) et de l’ADN (méthylé/non méthylé) vont induire soit la compaction de la chromatine (l’expression génique est alors réprimée), soit la décondensation de la chromatine (la régulation de la transcription est alors possible du fait de l’accessibilité des facteurs stimulateurs aux régions régulatrices des gènes)(1). De façon générale, la méthylation de l’ADN est associée à une désacétylation des histones dans les régions où la chromatine est compactée, empêchant l’expression génique. Au contraire, lorsque l’ADN est déméthylé et les histones acétylées, la chromatine est dans une conformation ouverte permettant l’expression des gènes (figure 1).
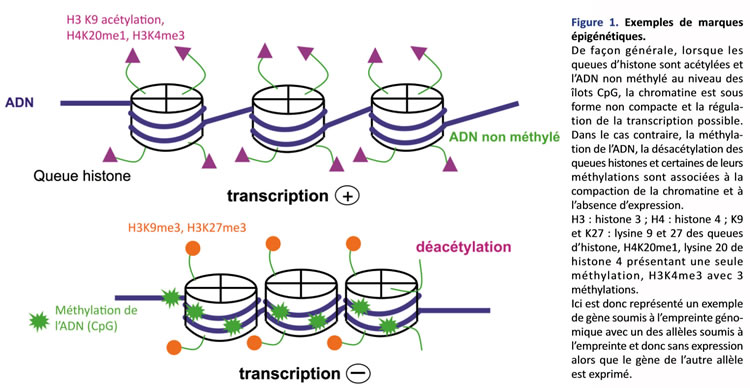
De plus, certains gènes soumis à empreinte codent pour des ARN non traduits (ex. : H19et KCNQ1OT1pour la région du bras court du chromosome 11: 11p15) dont on ne connaît pas encore parfaitement le rôle. Ils inhiberaient l’expression des gènes adjacents.
Les marques épigénétiques les plus connues :
– méthylation de l’ADN ;
– modifications post-traductionnelles des histones sur lesquelles s’enroule l’ADN ;
– les ARN non codants.
L’empreinte parentale
L’empreinte parentale, encore appelée « empreinte génomique », a été mise en évidence chez les mammifères dans les années 1980 grâce à des expériences de transferts nucléaires qui ont permis de démontrer la non-équivalence des 2 génomes parentaux : la formation de zygotes gynogénotes (2 génomes maternels) conduit à un développement embryonnaire mais à l’absence de développement des annexes embryonnaires, alors que la formation de zygotes androgénotes (2 génomes paternels) conduit au développement des annexes sans développement embryonnaire. Ces expériences ont démontré que pour obtenir un développement normal, il ne suffit pas d’avoir un génome diploïde, mais qu’une contribution paternelle et maternelle est indispensable, faisant suspecter l’expression allèle spécifique de gènes impliqués dans le développement précoce. L’empreinte parentale était ainsi mise en évidence. L’empreinte parentale dite « différentielle », encore appelée « empreinte génomique », est un des aspects de la régulation épigénétique. Elle a été décrite d’abord pour un gène précis grâce à l’inactivation (knock out) du gène d’IGF-2 chez la souris. Pour la mutation du gène d’IGF-2, les souris hétérozygotes présentaient un retard de croissance à la naissance uniquement quand la mutation provenait de l’allèle d’origine paternelle. La croissance était normale en cas de transmission maternelle du gène muté. Les souris homozygotes, pour la mutation, ne présentaient pas de phénotype plus sévère que les souris hétérozygotes avec mutation de l’allèle paternel. Alors que les deux loci sont identiques quant à leur séquence nucléotidique (code génétique), ils sont donc fonctionnellement différents. L’expression est monoallélique et un seul des 2 allèles parentaux est exprimé, tandis que l’autre allèle reste silencieux. Alors que la grande majorité des gènes sont exprimés par les 2 allèles parentaux, moins de 1 % des gènes sont soumis à cette empreinte parentale. Ces 2 allèles ont subi des modifications épigénétiques différentes (méthylation, acétylation, etc.) selon leur origine parentale, aboutissant à l’expression ou à la non-expression d’un gène en fonction de cette origine parentale (figure 1). Ces marques épigénétiques sont effacées dans les gamètes, puis apposées de façon différente en fonction du sexe de l’individu, lors de la maturation des gamètes. Après la fécondation, durant la période préimplantatoire, ces marques épigénétiques doivent être protégées d’une vague de déméthylation puis d’une reméthylation globale du génome. Au cours de ces dernières années, plusieurs régions chromosomiques soumises à empreinte – donc fonctionnellement différentes en fonction de l’origine parentale – ont été décrites. Les gènes soumis à empreinte sont regroupés en plusieurs clusters sur le génome (6q24-27, 7q31-32, 11p15, 15q1113, etc.), suggérant un contrôle coordonné des gènes d’une région soumise à l’empreinte. Ces contrôles sont assurés par certaines régions méthylées différentiellement appelées « centres d’empreinte » (Imprinting Center Region : ICR) régulant l’expression monoallélique de plusieurs gènes dans une région donnée. Moins de 1 % des gènes sont soumis à l’empreinte parentale : un seul des 2 allèles parentaux est exprimé, tandis que l’autre allèle reste silencieux. Le souvenir de cette empreinte est transmis lors de la mitose d’une cellule mère aux cellules filles.
La région chromosomique 11p15 : exemple de loci soumis à l’empreinte génomique
Alors que la grande majorité des gènes sont exprimés par les deux allèles d’origine maternelle et paternelle, seulement environ 1 % des gènes sont soumis à l’empreinte et alors exprimés de façon monoallélique. Plusieurs gènes impliqués dans la croissance embryonnaire et fœtale sont soumis à l’empreinte génomique. Il existe deux périodes critiques dans la mise en place ou le maintien de l’empreinte : la gamétogenèse et le développement précoce préimplantatoire du zygote. La reprogrammation majeure prend place dans les cellules germinales primordiales dans lesquelles l’empreinte est effacée et où leur totipotence est restaurée. Les marques de l’empreinte sont ensuite apposées durant la spermatogenèse ou l’ovogenèse en fonction du sexe. Après la fécondation, il existe une déméthylation globale du génome qui sera suivie d’une vague de méthylation de novo, mais dont les loci soumis à l’empreinte sont protégés(4). Concernant la région du bras court du chromosome 11 humain (11p15), certains gènes sont exprimés à partir de l’allèle paternel (IGF-2, KCNQ1OT1), et d’autres à partir de l’allèle maternel (H19et CDKN1C) (figure 2a).
- La perte de l’allèle d’origine maternelle, structurale dans 25 % des cas (isodisomie paternelle, c’est-à-dire perte de l’allèle maternel et duplication de l’allèle paternel) ou fonctionnelle par anomalie épigénétique ou épimutation (déméthylation au locus KCNQ1OT1 sur l’allèle maternel dans 60 % des cas ou gain de méthylation de la région ICR1/H19 sur l’allèle maternel dans 10 % des cas) (figure 2c), engendre un syndrome de croissance excessive : le syndrome de Beckwith-Wiedemann (BWS), avec, en fonction de l’anomalie moléculaire, une surexpression d’IGF-2 (facteur de croissance), de KCNQ1OT1 (ARN non codant), l’extinction de H19(ARN non codant) et de CDKN1C(inhibiteur du cycle cellulaire). Enfin, dans 5 % des cas, une mutation de ce dernier gène peut être impliquée. Le BWS s’accompagne d’une croissance excessive fœtale (taille et poids de naissance) et postnatale, d’une viscéromégalie, d’une macroglossie, d’anomalies du développement telles qu’omphalocèle, hernie ombilicale ou hypertrophie hémicorporelle. Des tumeurs (néphroblastome ou tumeur de Wilms, neuroblastome, hépatoblastome, corticosurrénalome, rhabdomyosarcome) sont associées dans environ 10 % des cas, cette fréquence pouvant varier de 2 à 30 % des cas selon l’anomalie moléculaire en cause (centromérique ou télomérique)(5)en étant surtout associée aux anomalies localisées au niveau de ICR1.
- À l’inverse, une perte de méthylation de l’allèle paternel, strictement localisée au centre local régulateur d’empreinte (ICR1) régulant IGF-2et H19 (figure 2b),est la cause la plus fréquente du syndrome de Silver-Russell (SRS) par extinction d’IGF-2 et surexpression d’H19(5).Ce syndrome, miroir du syndrome du BWS, associe un retard de croissance intra-utérin et postnatal avec périmètre crânien normal, une asymétrie hémicorporelle de type hypotrophie, des anomalies faciales caractéristiques et des troubles alimentaires parfois majeurs.
La mise en place ou le maintien de l’empreinte génomique se situe lors de deux périodes critiques : la gamétogenèse et le développement précoce préimplantatoire du zygote. L’AMP perturberait ces deux périodes.
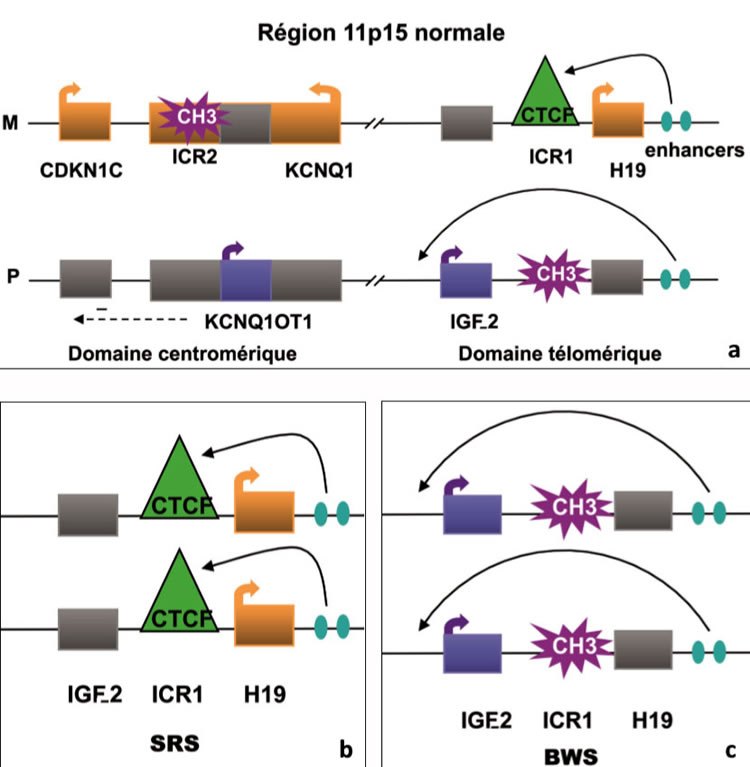
Figure 2. Anomalies d’empreinte de la région chromosomique 11p15.
2a : La région 11p15 est soumise à l’empreinte parentale et est divisée en deux domaines, centromérique et télomérique. L’empreinte réciproque du gène H19 (ARN non codant) exprimé par l’allèle maternel (M) et le gène IGF-2exprimé par l’allèle paternel (P) dépend de l’ICR1méthylé différentiellement en amont du gène H19. Cet ICR1agit ainsi comme un insulateur. En effet, le facteur CTCF lie l’ICR1maternel non méthylé et empêche le promoteur du gène d’IGF-II d’interagir avec les « enhancers » (stimulateurs de l’expression) se trouvant en aval du gène H19. Cela aboutit à un silence transcriptionnel de l’allèle IGF-2maternel. Sur l’allèle paternel, ICR1est méthylé prévenant la liaison de CTCF, et conduit à la transcription d’IGF-2paternel et à la non-expression d’H19. Le domaine centromérique ICR2fonctionne comme un « silenceur » en produisant un ARN non codant (KCNQ1OT1). Cela induit en cis (à proximité et sur le même chromosome) le silence des gènes paternels du domaine, dont CDKN1C(inhibiteur des cyclines cdk de la phase G1 du cycle et donc inhibiteur du cycle cellulaire). Les gènes paternels exprimés sont représentés par les boîtes bleues, les gènes maternels par les boîtes orange et les non- exprimés par les boîtes grises.
2b : Dans le cas du syndrome de Silver-Russell (SRS), la déméthylation anormale d’ICR1au niveau de l’allèle paternel entraîne l’expression biallèlique d’H19 et inhibe l’expression d’IGF-2, responsable du retard de croissance intra- utérin.
2c : Dans le cas du syndrome de Beckwith-Wiedemann (BWS), un des mécanismes pathologiques est dû à la méthylation anormale d’ICR1 au niveau de l’allèle maternel entraînant l’expression biallèlique d’IGF-2, responsable de la croissance excessive, et l’inhibition d’expression de H19. Les anomalies représentées en figures2bet 2csont celles qui ont été mises en évidence chez les patients issus d’AMP.
Anomalies de l’empreinte associées à l’AMP
La gamétogenèse et la période précoce post-fécondation représentent des fenêtres critiques de perturbation de la mise en place de l’empreinte par des facteurs environnementaux. Une fréquence anormalement élevée d’AMP a été notée dans les séries de BWS, suggérant que celle-ci puisse avoir une incidence sur les anomalies de l’empreinte(6). Une fréquence anormalement élevée d’AMP a été également notée récemment dans les séries de patients SRS. Dans les BWS, il s’agit d’une perte de méthylation de l’allèle maternel au niveau de la région centromérique ICR2 (KCNQ1OT). En revanche, c’est une déméthylation d’ICR1 de l’allèle paternel qui a été montrée dans le miroir clinique qu’est le SRS. La fréquence d’enfants issus d’AMP dans ces populations de BWS ou de SRS est plus élevée – respectivement 7,5 % et 4,9 % – que dans la population générale française (2 %). D’autres pathologies d’empreinte associées à l’AMP ont été décrites, qu’il s’agisse, chez les animaux (ovins et bovins), de croissance excessive (large offspring syndrome [LOS]) avec perte de méthylation du DMR2 maternel du gène du récepteur de type 2 des IGF (localisé en 6q26 chez l’humain), ou, chez les humains, du syndrome d’Angelman avec perte de méthylation de l’ICR maternel de Snrpn (localisé en 15q11-13). Dans les désordres de l’empreinte parentale décrits après AMP, l’épimutation implique toujours une perte de méthylation, qu’il s’agisse de l’allèle maternel ou paternel. Les causes à l’origine de ces anomalies d’empreinte ne sont pas connues. Il peut s’agir d’une des procédures de l’AMP aussi bien que de la stimulation ovarienne (la fin de la mise en place de l’empreinte de l’ovocyte se réalise lors de la période qui précède l’ovulation) ou de la cause de l’hypofertilité. Pour l’instant, les premières études n’ont pas pu imputer ces anomalies à une technique d’AMP particulière puisque ces anomalies d’empreinte ont été mises en évidence dans chacune. Il est donc important de procéder à des études prospectives sur de plus larges cohortes pour mieux définir les mécanismes mis en cause. Enfin, si chez la majorité des patients, l’atteinte épigénétique est localisée à un seul locus soumis à empreinte, certains patients présentent des anomalies de méthylation sur plusieurs loci. Ces données suggèrent que les troubles de la méthylation de l’ADN survenant après la fécondation pourraient impliquer un (des) facteur(s) contrôlant en trans la régulation des marques de méthylation. Mais ces atteintes multilocus ont été également mises en évidence dans les cohortes de patients BWS et SRS issus de grossesses spontanées. Cela montre que l’AMP n’est qu’une des causes parmi tant d’autres – environnementales ou génétiques – responsables des anomalies épigénétiques d’empreinte.
Conclusion
Parmi les pathologies épigénétiques d’empreinte telles que celles rencontrées chez les patients BWS et SRS, la prévalence de l’AMP est plus élevée que dans la population générale. Quelle est la procédure impliquée ? Les patients présentent une même anomalie épigénétique : une déméthylation d’un allèle d’origine maternelle pour les BWS et une déméthylation d’un allèle d’origine paternelle pour les SRS Le défaut épigénétique des patients BWS nés d’AMP n’est pas réservé à la région 11p15. L’atteinte de plusieurs loci (BWS et SRS) est en faveur de l’implication d’un facteur intervenant en trans soit dans l’apposition, soit dans le maintien des marques d’empreinte. Quel est l’impact de l’AMP sur ce facteur trans ?
Des études prospectives sont nécessaires pour comprendre les mécanismes et les causes de ces anomalies épigénétiques et d’empreinte.
Bibliographie
Le Bouc Y
L’aide médicale à la procréaion induit-elle des anomalies épigénétiques ?
Infertilité, 27 nov 2014
Références
DeChiara TM, Robertson EJ, Efstratiadis A
Parental imprinting of the mouse insulin-like growth factor II gene
Cell. 1991 Feb 22;64(4):849-59
Demars J, Le Bouc Y, El-Osta A, Gicquel C
Epigenetic and genetic mechanisms of abnormal 11p15 genomic imprinting in Silver-Russell and Beckwith-Wiedemann syndromes
Curr Med Chem. 2011;18(12):1740-50
Gicquel C, Gaston V, Mandelbaum J, Siffroi JP, Flahault A, Le Bouc Y
In vitro fertilization may increase the risk of Beckwith-Wiedemann syndrome related to the abnormal imprinting of the KCN1OT gene
Am J Hum Genet. 2003 May;72(5):1338-41
Le Bouc Y, Rossignol S, Azzi S, Brioude F, Cabrol S, Gicquel C, Netchine I
Epigenetics, genomic imprinting and developmental disorders
Bull Acad Natl Med. 2010 Feb;194(2):287-97; discussion 297-300
McGrath J, Solter D
Completion of mouse embryogenesis requires both the maternal and paternal genomes
Cell. 1984 May;37(1):179-83
Reik W, Walter J
Genomic imprinting: parental influence on the genome
Nat Rev Genet. 2001 Jan;2(1):21-32
Et pour aller plus loin
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Amitié et sélection naturelle - Cette étude de l’université de Yale montre la proximité génétique entre amis. Nos amis ont [...]
Thérapie adaptative naturelle du cancer - Abstract Les recherches suggèrent que la survie sans progression peut être prolongée en [...]
Un vaccin polyvalent des cancers est-il possible ? - Les cancers sont aussi vieux que la multicellularité. Ils sont apparus chez tous [...]
La tuberculose a façonné notre immunité - Comment la tuberculose a remodelé notre système immunitaire La tuberculose était si mortelle à [...]
Inconvénients et avantages de l'infertilité masculine - Darwin prit le risque d’annoncer que la découverte d’un caractère usuel qui [...]
Livres de biologie et médecine évolutionnistes
Le temps des pères - Sarah Blaffer Hrdy ▪ La Découverte, août 2025 Sarah Hrdy est connue pour avoir démontré [...]
Du bon sens dans notre assiette - Anthony Berthou ▪ Actes Sud, février 2023 Les ouvrages sur la nutrition abondent, et [...]
Comment nous sommes devenus ce que nous sommes - David Reich ▪ Quanto, 2019 La science de l'ADN ancien, née dans les années 2000, a [...]
Destinées improbables
Le hasard, la nécessité et l'avenir de l'évolution - Jonathan B Losos ▪ La Découverte, 2021
Ce livre aborde trois aspects de la biologie de [...]
L'origine des troubles mentaux - Randolph Nesse ▪ Markus Haller, 2021 Randolph Nesse et George Williams ont été les premiers [...]
Articles et autres publications
Alzheimer : et si l'on disait enfin la vérité - Alternatif bien-être, N° 218, novembre 2024 [...]
Les antidépresseurs entre mythes et réalités (deuxième partie)ie) - Raison sensible, octobre 2024 [...]
Les antidépresseurs entre mythe et réalité (première partie) - Raison sensible, octobre 2024 [...]
un grand pas dans l'histoire des médicaments - Médecine. 2024;20(2):95-96. [...]
Le mamelon masculin - Planet vie, fevrier 2023 [...]
La phrase biomédicale aléatoire
Pour qu'une situation soit une cause de souffrance, il faut impérativement qu'elle influence la façon dont la personne perçoit les événements futurs
― E.J. Cassel
