Ocytocine synthétique en obstétrique
dernière mise à jour le 21/01/2025
Au-delà du travail, le rôle de l’ocytocine naturelle et synthétique dans la transition vers le comportement maternel
Abstract
L'ocytocine endogène est un élément clé de la transition vers la maternité, affectant les voies biologiques de réaction au stress, elle favorise l'humeur positive et régule les comportements maternels sains (y compris l’allaitement). L’obstétrique moderne utilise largement l'ocytocine synthétique tout au long du travail et en postpartum. Pourtant, les recherches sur les implications de l’exposition à l’ocytocine périnatale sont rares. Dans cet article, nous passons en revue les voies biologiques et les comportements associés à la transition vers la maternité, et les preuves appuyant la nécessité de poursuivre les recherches sur les effets potentiels de l'ocytocine en obstétrique, au-delà du travail.
Nous inclurons aussi une approche de l'ocytocine au niveau moléculaire.
Introduction
Les conséquences des interventions systématiques sur l'accouchement sont très peu étudiées. L'ocytocine synthétique (Pitocin®, Syntocinon®) stimule la contractilité du muscle lisse de l'utérus et est largement utilisée pour le déclenchement et l’augmentation des contractions, et aussi pendant la délivrance. Bien que l'utilisation judicieuse de l'ocytocine synthétique présente de nombreux avantages, ses effets biologiques et comportementaux au-delà de ce stade clinique immédiat sont largement inconnus. Aux USA, le déclenchement artificiel a plus que doublé de 1990 (10%) à 2010 (23%) (1) . L’estimation actuelle de son taux d'utilisation pour accélérer les contractions est de 57% (2).
Alors que l'ocytocine endogène est bien connue pour son rôle dans le travail et la lactation, ses divers rôles dans les voies endocrines de régulation de la réactivité au stress, dans le bien-être émotionnel et mental, et dans la promotion de l’attachement, sont largement démontrés (3) ,(4) Ces comportements sont essentiels pour une transition réussie vers le comportement maternel. Étant donné l’usage important de l'ocytocine synthétique en obstétrique, il est très important d’étudier son impact sur la régulation de l’ocytocine naturelle, et sur les processus physiologiques qui y sont liés. Nous examinons ici l’hypothèse selon laquelle l'exposition à l'ocytocine synthétique pendant l'accouchement peut avoir des répercussions sur la réactivité au stress, l'humeur et les comportements de la mère (y compris sur l’allaitement).
L’OCYTOCINE AU NIVEAU MOLÉCULAIRE
Des changements profonds se produisent dans le système physiologique de l'ocytocine pendant la période périnatale(5) , (6). Pour empêcher une naissance prématurée, la neuromédiation de l'ocytocine est inhibée pendant la grossesse. Ce neuropeptide continue à s'accumuler dans l'hypophyse postérieure, et à terme, les mécanismes inhibiteurs sont levés pour permettre le travail de l’accouchement. La disponibilité de l'ocytocine est également augmentée par réduction de l'activité enzymatique qui métabolise l'ocytocine dans le cerveau. Des études animales montrent que l'expression des récepteurs d'ocytocine (OTR) augmente tout au long de la grossesse dans les zones clés du cerveau qui régulent l'humeur, le stress et le comportement d'attachement. Chez les humains, la disponibilité d'OTR dans le muscle utérin augmente également de façon spectaculaire à terme, en prévision des pics d'ocytocine nécessaires à l’expulsion.
Origine neurologique de l'ocytocine
L'ocytocine est un petit neuropeptide composé de neuf acides aminés.7 Tout au long de la vie humaine, des neurones spécifiques en fabriquent ; ces neurones sont abondants dans des zones particulières de l'hypothalamus des mammifères : les noyaux paraventriculaires et supraoptiques. L'ocytocine est transportée vers l’hypophyse postérieure qui la libère dans la circulation, pour la distribuer dans tout le corps. Dans le système nerveux central, l'ocytocine atteint presque toutes les parties du tronc cérébral, du mésencéphale, du cortex et de la moelle épinière. L’hypophyse et l’hypothalamus sont donc les principales sources de production, mais certains organes périphériques et tissus peuvent aussi sécréter de l'ocytocine (7) .
Récepteurs de l'ocytocine: comment l'ocytocine affecte la physiologie du cerveau et du corps
Pour affecter les tissus cibles, il faut un récepteur auquel se lie l'ocytocine pour déclencher l’action au niveau cellulaire. Les récepteurs de l'ocytocine (OTR) sont présents dans tout le corps, avec des concentrations particulièrement élevées dans les régions limbiques du cerveau, la moelle épinière, le cœur, les intestins, lu tissu immunitaire, l'utérus et le sein. Ces OTR appartiennent à la grande famille dite des « récepteurs couplés aux protéines G », très fréquents chez les mammifères, et impliqués dans divers reconnaissances de signaux (hormones, neurotransmetteurs, odeurs, lumière, goût). L'OTR est couplé à une protéine du type G-qα qui augmente le calcium intracellulaire et la contraction des cellules musculaires, particulièrement importante pour la libération du lait et les contractions utérines (voir Figure 1) (7), (8) .
Lorsque l'OTR est sur un neurone, la réponse peut être la libération ou l'inhibition ultérieure d'autres neurotransmetteurs et modulateurs hormonaux, comme la sérotonine, les opioïdes endogènes et le facteur de libération de la corticotrophine3. Ces interactions avec le système nerveux sont essentielles pour comprendre comment l'ocytocine libérée dans le cerveau influence une grande variété d'états mentaux et de comportement. Il peut également aider à expliquer que divers stimuli internes et externes conduisent à sa libération ou à son inhibition. De plus, l'ocytocine se lie à d'autres types de récepteurs, tels que ceux de la vasopressine, y exerçant des effets agonistes ou antagonistes, majorant et diversifiant ainsi les conséquences des actions de l'ocytocine.
Les voies médiées par l'ocytocine au-delà de la contraction musculaire
Dans toutes les cellules, pas seulement les neurones, trois autres fonctions importantes des OTR peuvent conduire à un éventail d'actions cellulaires. 1/ Grâce à l'activation de la protéine G intracellulaire, la phospholipase C provoque une quantité encore plus grande de libération de Ca + dans la cellule à partir des réserves internes. Ce Ca + peut servir de signal indépendant pour diverses fonctions, en particulier dans les cellules nerveuses. 2/ Une autre fonction est la création d'eicosanoïdes dont les prostaglandines qui peuvent directement augmenter la douleur, l'inflammation, et probablement la contraction utérine. 3/ Troisièmement, l'activation d’OTR peut conduire à une large catégorie d'événements cellulaires en activant une kinase spécifique, une enzyme qui catalyse l'addition d'un groupe phosphate sur une molécule ou une protéine cible spécifique. Dans ce cas, la protéine kinase C est activée et nécessite Ca +. Les effets "en aval" de l'activation OTR dépendront du type de cellule sur laquelle le récepteur est situé. Cette kinase peut initier une action spécifique ou provoquer l'activation d'une autre kinase, puis d’une autre, créant littéralement une cascade d'événements (7). Ces événements peuvent finalement conduire à modifier la transcription génique, la régulation du cycle cellulaire, l'apoptose et / ou la neurogénèse. Le résultat final de chaque voie initiée par l'ocytocine dépend du type de cellule impliquée (utérus, cerveau, cœur, etc.) et du type de réponse initiée dans cette cellule. L'activation des OTR peut induire des altérations biologiques durables.
DÉFIS DANS L'ÉTUDE DE L'OCYTOCINE AU NIVEAU MOLÉCULAIRE - CERVEAU VERSUS CORPS
Dans le cadre de l'accouchement, la demi-vie de Pitocin® est estimée à seulement quelques minutes (9), et les taux plasmatiques de la parturiente sont corrélés à la dose administrée (10) , mais la dose administrée par voie intraveineuse peut ou non entraîner une contraction utérine efficace. De même, les niveaux plasmatiques d'ocytocine n’ont pas obligatoirement un effet significatif sur l'activité cérébrale. Afin de comprendre comment l'exposition à l'ocytocine périnatale peut avoir des conséquences biologiques durables, il est utile de comprendre certaines des contraintes qui peuvent limiter la recherche et l'interprétation dans ce domaine. De nombreuses études portant sur l'ocytocine endogène chez l'animal et chez l'homme reposent sur la mesure sanguine de l'hormone en réponse à un traitement, une intervention, un événement stressant ou une interaction sociale. Il y a plusieurs difficultés dans l'interprétation de ces mesures.
Tout d'abord, l'ocytocine du système nerveux central est sécrétée en continu et agit dans le cerveau et la moelle épinière, mais l'ocytocine est également libérée par pics dans la circulation sanguine par le biais de l'hypophyse postérieure. La libération pulsatile d'ocytocine se produit lorsque les neurones d'ocytocine de l'hypophyse postérieure se dépolarisent, généralement en réponse à des stimuli spécifiques (stimuli utérins ou signaux émis par le nouveau-né) (11),(12) . Cette activation des neurones libère l'ocytocine dans la circulation sanguine. Les données recueillies chez le rat suggèrent des corrélations entre les niveaux périphériques endogènes (sang) et l'ocytocine centrale, bien que le degré et la signification de ces corrélations varient(13) .
En outre, il existe une controverse quant à savoir si l'ocytocine administrée par voie périphérique (c'est-à-dire la Pitocin® administrée par voie intraveineuse ou intramusculaire) traverse la barrière hémato-encéphalique. Et si elle la traverse, il reste encore à déterminer dans quelle mesure cette ocytocine change significativement l'activité neuronale(14) . En théorie, l'ocytocine ne peut pas traverser cette barrière en raison de sa taille relativement grande et de sa nature hydrophile, cependant, certaines études animales rapportent de faibles taux d'ocytocine intracérébrale après administration intraveineuse (15). Il est intéressant de noter que des études basées sur l'électrophysiologie suggèrent que l'ocytocine maternelle joue un rôle neuroprotecteur dans le cerveau fœtal pendant l’accouchement, ce qui signifie qu'elle a dû traverser les deux barrières : placentaire et hémato-encéphalique (16). Ces études suggèrent que l'ocytocine maternelle inhibe la dépolarisation de certains neurones fœtaux excitateurs (GABA), les protégeant ainsi pendant les périodes d'hypoxie liée à la naissance. Cependant, que l'ocytocine synthétique ou endogène pénètre le cerveau maternel n'a pas encore été prouvé. Alors que la libération d'ocytocine dans la circulation par l’hypophyse postérieure se produit après activation neuronale. L'introduction de l'hormone circulante dans le cerveau nécessiterait, soit un mécanisme de transport actif pour pénétrer la microvascularisation serrée du système nerveux central (ce qui n'a pas encore été prouvée), soit une barrière plus poreuse pour permettre la diffusion(17) . La barrière hémato-encéphalique (maternelle ou fœtale) peut devenir plus poreuse dans les états de maladie ou stress.
Enfin, le cerveau peut recevoir des informations sur les niveaux périphériques d'ocytocine
pat rétroaction du système nerveux périphérique. Les nerfs périphériques peuvent communiquer des informations sur les niveaux d'ocytocine au cerveau, vraisemblablement par une boucle de rétroaction (par exemple dilatation cervicale, activité des glandes surrénales, stimulation du toucher et du mamelon). Il existe également des effets bien étudiés de l'administration intranasale d'ocytocine synthétique sur l'humeur et le comportement social, mais on ignore encore si la voie intranasale permet à l'ocytocine d'entrer dans le cerveau directement ou par voie extraneuronale, ou si elle stimule un effet rétroactif sur l'ocytocine endogène par des voies nerveuses ascendantes ou afférentes (ex : nerf vague ou X) qui possèdent toutes deux des OTR(18) . Les effets périphériques de l'ocytocine, qui peuvent être transmis au cerveau, sont difficiles à surveiller, et ils compliquent l'étude de l'ocytocine synthétique. On ignore si le cerveau maternel répondra de façon fiable à l'ocytocine exogène en diminuant ou en augmentant la synthèse ou la libération d'ocytocine endogène. En contexte clinique, ce type de rétroaction pourrait être observé lorsque Pitocin ® est utilisé pour amorcer une induction du travail, puis cessé lorsque le travail se poursuit sans le médicament. Il est probable qu’existe une rétroaction sur le cerveau à partir de la dilatation cervicale, favorisant la libération endogène de l'ocytocine chez la femme, ce qui est plus probable qu’une pénétration directe de Pitocin® dans le cerveau maternel.
Cependant, compte tenu de toutes ces variables, des niveaux plasmatiques maternels altérés persistant au-delà de la fin du travail ont été trouvés dans une étude évaluant les taux d'ocytocine post-partum en réponse à l'allaitement deux jours après la naissance chez les femmes ayant eu différentes expositions intrapartum et postpartum à l'ocytocine synthétique(19) Les femmes exposées à Pitocin® en milieu de travail combiné à une péridurale ont montré des niveaux d'ocytocine significativement inférieurs pendant l'allaitement. Dans l'ensemble, la quantité totale d'ocytocine synthétique administrée pendant la parturition était corrélée négativement aux niveaux d'ocytocine plasmatique deux jours après la naissance. Toutes ces naissances étaient vaginales et les scores Apgar des nouveau-nés étaient normaux. Dans ces études, la durée moyenne du travail ne différait pas significativement entre les groupes, ni la perte de sang, ni le poids du nouveau-né. Les femmes ont toutes commencé l'allaitement maternel quelques minutes après leur naissance et avaient la même alimentation. Si elle est reproductible, cette découverte suggère que l'exposition à Pitocin® peut avoir des conséquences maternelles qui se prolongent au-delà de l'accouchement.
L'altération des récepteurs d'ocytocine peut-elle modifier le fonctionnement de l'ocytocine
Comme examiné ci-dessus, l'OTR doit être présent pour que l'ocytocine exerce son action. Une considération importante pour savoir si l’ocytocine synthétique peut affecter la physiologie maternelle est sa capacité à saturer l'OTR. En réponse à la saturation, un récepteur est parfois ‘internalisé’ (déplacé de la membrane cellulaire pour être disponible et potentiellement dégradé). En présence de niveaux élevés d'un agoniste, l'internalisation du récepteur peut commencer en quelques minutes. Il a été démontré que le processus inverse prend environ quatre heures pour resensibiliser le récepteur après l'élimination de l'agoniste (20). Cependant, le travail a porté sur des cellules de myomètre in vitro, et on ignore si les neurones in vivo peuvent internaliser et resensibiliser les OTR de façon identique. Si tel était le cas, cela aurait des implications sur le comportement maternel.
Une autre stratégie contre la saturation serait que les récepteurs puissent être internalisés et ensuite régulés à la baisse, par une pause dans la transcription du gène de l'ARNm pour le récepteur. La recherche sur le travail induit s'est concentrée sur l'échantillonnage du myomètre pour l'expression du gène OTR(21) . Une étude a comparé 33 femmes en travail spontané avec 30 ayant subi un déclenchement et avec 29 femmes qui avaient planifié une césarienne par choix.
18 des 33 femmes du groupe spontané ont finalement reçu de l’ocytocine synthétique pour accélérer le travail, ainsi que 26 des 30 femmes du groupe induit. Toutes ont eu des césariennes pour défaut de progression ou intolérance au travail et le myomètre a été échantillonné à ce moment-là. La liaison à l'ocytocine, ainsi que les taux d'ARNm de l'OTR, ont été significativement affectés par l'utilisation d'ocytocine synthétique. Les participantes ayant eu un travail induit par l'ocytocine avaient une régulation du gène OTR du muscle utérin 300 fois moindre, comparativement à la disponibilité du récepteur en cas de travail spontané. Cette étude suggère que l'OTR peut régresser dans l'utérus en cas de travail induit ou accéléré. Elle souligne la nécessité d'étudier la liaison de l'ocytocine dans d'autres régions du corps telles que le cerveau maternel, le sein, le cœur, l'intestin ou le système immunitaire. La «gestion active» de la troisième phase du travail n’a pas été étudiée, mais étant donné la prévalence de cette pratique, il faudrait aussi le faire.
La durée de cette baisse d’activité de l'ARNm dans l'OTR en réponse à l'ocytocine synthétique n'est pas encore connue. Considérant que le mécanisme cellulaire pour la régénération du récepteur comprendrait la transcription, la traduction, l'assemblage / le pliage des protéines et le transport vers la membrane cellulaire, cela pourrait prendre beaucoup plus d'heures que l'internalisation simple du récepteur, et la restauration complète d'un OTR fonctionnel pourrait nécessiter des jours. De plus, lorsqu’un tissu donné n'est plus exposé à un agoniste saturant (travail), et s'il n'y a pas de stimulus pour libérer de l'ocytocine endogène (par exemple toucher, allaitement), la réponse au "besoin" perçu du système peut varier entre les différents types de naissance et post-partum.
Le rôle de la régulation épigénétique de l'OTR
À plus long terme, la régulation des récepteurs peut également se produire au niveau de la transcription des gènes pour le récepteur par modulation épigénétique. Par exemple, la méthylation est un mécanisme par lequel l'expression génique est régulée à la baisse. L'attachement d'un groupe méthyle (CH3) peut se produire sur des sites spécifiques le long de la séquence d'ADN. Un gène de récepteur qui est plus lourdement méthylé réduit le gène au "silence", empêchant l'activation de la transcription. La méthylation du gène OTR est un exemple de mécanisme qui peut réguler vers le bas l'expression du gène OTR, avec des effets qui peuvent être héréditaires. Par exemple, si le gène OTR est silencieux, moins d'OTR sera disponible sur la membrane cellulaire. À son tour, l'OTR est moins disponible pour se lier à l'ocytocine, ce qui peut entraîner une diminution des effets biologiques et comportementaux.
Il existe des périodes sensibles au cours du développement des mammifères pendant lesquelles l'environnement peut entraîner la méthylation de l'ADN(22) . Par exemple, les modèles de rongeurs montrent que les soins maternels précoces peuvent être liés à des schémas de méthylation chez les phénotypes maternels et génitaux avec un effet transgénérationnel(23) . Hypothèse selon laquelle la modification épigénétique de l'OTR a un rôle dans la cognition sociale, la réactivité au stress et les troubles sociaux du comportement(24) . Par exemple, une étude a examiné le rôle de la méthylation de l'OTR chez les personnes atteintes d'autisme. L'hyperméthylation de la région de l'ADN contrôlant l'OTR a été observé dans le sang des individus touchés par rapport aux témoins (n = 20 couples appariés). Cet effet a également été démontré dans le cerveau post-mortem de 8 patients-témoins appariés, montrant une corrélation entre la méthylation des OTR du cerveau et du sang (25). Les données pilotes chez les rongeurs suggèrent que la naissance normale avec de l'ocytocine endogène, ainsi que l'exposition à l'ocytocine synthétique intrapartum, peuvent produire une modulation épigénétique de l'OTR en augmentant la méthylation des sites du gène OTR de l'hypothalamus maternel(26) .
OCYTOCINE ET TRANSITION VERS LA MATERNITÉ
L'expérience d'accoucher et de devenir mère, en particulier pour la première fois,
exige un niveau élevé d'interaction physique et sociale. Être sensible aux besoins du nourrisson grâce à une interaction synchrone mère-enfant est vital pour la poursuite de la famille et de l’espèce. La période du post-partum se caractérise aussi par des changements hormonaux drastiques, une transition vers la maternité, de nouveaux facteurs de stress, la douleur physique, la lactation et l'attachement - qui impliquent tous le système de l'ocytocine endogène. En outre, les responsabilités parentales modernes peuvent inclure des tensions financières, des obligations professionnelles, l'isolement social ou un soutien limité, et diverses constructions socioculturelles sur le «bon maternage ». Dans ce contexte, une transition difficile vers la maternité peut conduire à une dérégulation de la réactivité au stress, à des troubles de l'humeur, à une susceptibilité, à une moindre sensibilité, à une interaction mère-enfant asynchrone et à un mauvais attachement du nourrisson.
Réactivité au stress
Le cerveau maternel est dans un état biologique particulier, caractérisé par une multitude de mécanismes biochimiques favorisant le bien-être et la survie de la mère et du nourrisson6. Des adaptations importantes se produisent dans le système de l'ocytocine maternelle, pour la protection contre le stress et les exigences de la période périnatale L'augmentation spectaculaire de l'ocytocine au cours de la naissance physiologique peut jouer un rôle dans l'amortissement des hormones de stress libérées par la peur et la douleur du travail, selon des études sur les animaux et certains travaux humains (27). Cette réponse adaptative est probablement un mécanisme protecteur pendant l’intense stress de la période périnatale.
La relation entre l'ocytocine et l'axe hypothalamo-hypophyso-surrénalien dans la réponse aux stimuli stressants a été étudiée sur des modèles de rongeurs3. Ces études démontrent que les animaux gravides ont une réactivité réduite aux facteurs de stress, par le biais de taux plasmatiques réduits de facteur de libération de la corticotrophine, de facteur de libération de l'adrénocorticotropine et de cortisol. Il y a une inhibition de l'ocytocine et des neurones de cet axe pendant la grossesse due principalement à un mécanisme opioïde inhibiteur de l'alloprégnanolone (un métabolite de la progestérone)(6). Au cours de la lactation, les pics d'ocytocine augmentent dans le cerveau et l'hormone est libérée dans la circulation. Ces niveaux d'ocytocine qui augmentent influencent les neurones de réponse au stress. Les femelles allaitantes réagissent moins aux facteurs de stress et présentent moins de comportements anxieux que les femmes non allaitantes. L'ocytocine augmente, comme un mécanisme de protection contre le stress continu. Cela peut être constaté lorsque le facteur de libération du cortisol et de l'adrénocorticotropine diminue après administration d’ocytocine synthétique. Inversement, lorsqu'un antagoniste d'ocytocine est administré à des rats, leurs taux de cortisol augmentent. Cependant, chez les femmes, les relations entre l'ocytocine, l’axe hypotalamo-surrénalien et la réactivité au stress sont moins bien caractérisées. Des dosages d’ocytocine salivaire en période d'allaitement suggèrent que l'ocytocine peut augmenter chez les femmes avant l’allaitement, quand elles de préparent. Il y a également une diminution des hormones de l’axe hypotalamo-surrénalien en circulation immédiatement après le début de l'allaitement maternel. Cela est probablement dû à l'ocytocine du cerveau exerçant un effet sur
les neurones qui activent cet axe et le facteur de libération de la corticotrophine. Les femmes qui allaitent montrent une augmentation du tonus vagal, une baisse de la tension artérielle et une diminution de la fréquence cardiaque comparativement aux femmes non allaitantes, en particulier en réponse à un facteur de stress(28) . Comme nous l’avons dit, le nerf vague détecte des niveaux élevés d'ocytocine dans le corps et peut en informer rétroactivement le cerveau par des voies afférentes. Il est de plus en plus évident que l'ocytocine joue un rôle
tampon dans la réactivité au stress, et qu’elle est intrinsèquement liée au système de l’axe hypotalamo-surrénalien (27).
L'humeur maternelle
Comme pour la réactivité au stress, un système d'ocytocine bien régulé est anxiolytique et confère une protection contre l'humeur négative. Plusieurs études ont montré que l'administration intranasale d'ocytocine synthétique a un effet anxiolytique dans les troubles psychiatriques(14). Il est plus difficile de déterminer si l'ocytocine synthétique intrapartum confère la même fonction protectrice que l'ocytocine endogène sur la santé mentale maternelle, en particulier à la lumière de la complexité des nouvelles pratiques obstétricales. On estime que la dépression du post-partum affecte jusqu'à 19% des femmes(29) . Les femmes dépressives sont moins maternelles et moins sensibles aux besoins des nourrissons(30) . Une moindre qualité de l'interaction mère-enfant peut conduire à un attachement sous optimal et altérer le développement du nourrisson(31) , (32).
Bien qu'il existe des prédicteurs bien connus du post-partum blues (mauvaises conditions sociales, stress, évènements négatifs de vie, antécédents de dépression et d’anxiété), les variables subjectives et objectives de la naissance (complications, mode d'accouchement, interventions accrues et perception maternelle de l'expérience) peuvent également être des prédicteurs des symptômes maternels(33) , (34). Cependant, on sait peu de choses sur les fondements biologiques qui relient les variables de naissance à l'humeur du post-partum, et guère plus sur l'effet spécifique de l'exposition à l'ocytocine synthétique. L'utilisation de l'ocytocine synthétique est souvent associée à des complications préexistantes, mais même dans des situations à faible risque, elle peut précipiter une cascade d'interventions et de complications ultérieures de l’accouchement(35) . L'exposition à l'ocytocine synthétique pendant l'accouchement affecte l'humeur du post-partum. Cependant, d'après notre connaissance des effets de l'ocytocine dans d'autres situations et dans les tissus autres que ceux du système nerveux central, nous pensons que les effets de l'ocytocine synthétique sont dose-dépendants et montrent des différences individuelles, influencées par le contexte et l'histoire maternelle(36) .
Les modèles de rongeurs montrent les voies moléculaires de l'humeur que l’évolution a conservées chez les mammifères(37) . Par exemple, la sérotonine et la dopamine sont des médiateurs de l’action anxiolytique de l'ocytocine chez les humains et chez les rongeurs. Lorsque l'ocytocine endogène est bloquée génétiquement ou pharmacologiquement, un comportement analogue à l'anxiété et à la dépression augmente chez des souris knockout déficitaires en ocytocine par rapport aux souris sauvages(38) . En réponse à un stress, les rats rendus anxieux par élevage, montrent une libération plus élevée d’ocytocine centrale et des symptômes semblables à ceux de l'anxiété et de la dépression que des rats élevés pour être moins anxieux(39) . L'ocytocine est l'une des voies moléculaires évolutionnistes de l'humeur.
Chez l'homme, de nombreuses études ont révélé que des niveaux atypiques d'ocytocine périphérique (très élevés ou très faibles) peuvent être associés à des symptômes élevés de dépression, d'anxiété ou de stress post-traumatique(40) . Dans une étude chez 74 femmes, de faibles taux d'ocytocine en fin de la grossesse ont été associée à des symptômes supérieurs de dépression deux semaines après l'accouchement, après correction pour les symptômes préexistants, les caractéristiques sociales et les antécédents obstétricaux(41) . Le contexte individuel, les évènements adverses de la vie, les traumatismes, le génotype et les processus épigénétiques sont autant de facteurs qui peuvent modifier le système de l’ocytocine en plus ou en moins, et altérer la sensibilité à l'ocytocine synthétique pendant l'accouchement.
Comportements maternels
Le rôle de l'ocytocine endogène dans l'initiation du comportement maternel a été démontré chez de nombreuses espèces. La manipulation périnatale du système d'ocytocine chez les animaux fournit de fortes preuves de comportements maternels dysfonctionnels ultérieurs(42) ,(43) ,(44) ,(45) , (46).Par exemple, chez les rats, l'ocytocine intervient clairement dans l'initiation du comportement maternel. Chez les brebis, l'acceptation maternelle de leur agneau se produit après l'identification, mais une injection centrale d'ocytocine synthétique peut favoriser l'acceptation d’agneaux étrangers par la mère. Le comportement maternel optimal est bloqué chez les brebis et les génisses lorsque l'ocytocine centrale n'est pas libérée lors d'une naissance en raison d’une anesthésie régionale et d’un manque de stimulation vagino-cervicale. Chez les primates non humains, un comportement maternel optimal peut être modifié par une injection centrale d'ocytocine synthétique ou par un antagoniste de l'ocytocine.
Un modèle animal particulier a été utile pour comprendre le rôle de l'ocytocine dans
la mise en place des liens sociaux. Le campagnol de prairie est monogame, ce qui est rare chez les rongeurs. Il est postulé que le rôle tampon de la réactivité au stress de l'ocytocine est une fonction de l'interaction sociale et du lien4. On a pu modifier le comportement social de ces campagnols par exposition à l'ocytocine synthétique au début de vie. Par exemple, chez les petits des campagnols de prairies, l'exposition à l'ocytocine synthétique au premier jour de vie a eu des effets durables et dose-dépendants sur la capacité à former des liens de couple durables dans leur vie ultérieure. L'exposition à une faible dose d'ocytocine synthétique a facilité les couples durables, tandis que l'exposition à une dose élevée a inhibé la formation de couples(47) . L'exposition à un antagoniste de l'ocytocine au cours de la même période a inhibé les comportements sociaux ultérieurs, dont l’alloparentalité, probablement par une augmentation de l'anxiété. De plus, la naissance elle-même peut être critique dans l'initiation du comportement maternel des campagnols de prairie. Les femelles accouchées par césarienne ont montré un comportement infanticide ; tandis que les femelles accouchées par voie vaginale (avec simulation de chirurgie après la naissance pour éviter tout biais) n'ont pas ce comportement(48) .
Un ensemble croissant de preuves suggère un lien entre l'ocytocine et le comportement maternel optimal chez l’humain également(49) . Ce comportement optimal comprend les caresses, l’échange de regards, l’affection et le langage affectueux qui sont caractérisés par
leur sensibilité aux signaux des nourrissons et à une interaction mère-enfant synchrone(50) . La synchronie de l'interaction mère-enfant a un fort effet sur les états affectifs infantiles. De nombreuses études ont trouvé une association entre des niveaux atypiques d'ocytocine périphérique et un comportement maternel moins optimal50. La variation génétique (allèles à risque) et le gène OTR ont également été associés à un comportement moins optimal49,(51) ,(52) . Une étude sur 15 couples mère-enfant a révélé deux profils distincts de comportement cérébral à l’ocytocine entre les mères à comportement synchrone et celles à comportement intrusif(53) .Les mères synchrones avaient des taux plasmatiques d'ocytocine
en accord avec l'organisation neuronale des domaines liés à la récompense (noyau accumbens gauche et amygdale droite). En revanche, les mères intrusives ne présentent pas cette corrélation de niveau d’ocytocine avec l’activation de la récompense. De plus, le rôle de l'ocytocine dans le comportement maternel est liée aux expériences affiliatives de la femme tout au long de sa vie (parents, partenaires, enfants)(54) . Encore une fois, on ne sait pas si ces relations sont dérivées ou influencé par l'expérience même de la naissance, ou par l'utilisation d'ocytocine synthétique. Cependant, ces résultats suggèrent que l'ocytocine joue un rôle clé, au-delà du travail, dans la transition vers la maternité.
Allaitement
La transition physiologique vers la maternité comprend également la mise en place de la lactation. Quelques études récentes ont examiné la lactation dans le contexte de l'ocytocine synthétique et l'utilisation de l'anesthésie péridurale. Par exemple, en Suède, 351 femmes qui ont reçu une péridurale ont été comparées à 351 femmes sans péridurale(55) . Le succès de l'allaitement maternel a été négativement associé à la péridurale. Il est important de noter que les femmes qui ont été accélérées par l'ocytocine synthétique ont amorcé trois fois moins l'allaitement au cours des quatre premières heures et sont passées deux fois plus souvent à l’allaitement artificiel à la sortie de l'hôpital. Une autre petite étude sur 20 cas a examiné la durée de l'allaitement maternel par rapport à l'exposition à l'ocytocine synthétique pour induction ou accélération du travail. Toutes les mères avaient reçu une anesthésie péridurale. Les auteurs ont signalé une relation inverse entre la dose d'ocytocine synthétique et
une durée plus courte d'allaitement maternel exclusif(56) .
Conséquences pour la progéniture
Des études animales ont prouvé les conséquences négatives à long terme pour le comportement social et la gestion des expériences stressantes chez des juvéniles exposés à des manipulations par l'ocytocine au début de la vie. Par exemple, chez les porcelets, l'exposition à l'ocytocine intranasale au début de la vie provoque un comportement social atypique, des conduites non réciproques et une capacité altérée à répondre aux expériences stressantes dans la vie ultérieure(57) . Plusieurs études chez les rongeurs soutiennent de même l'hypothèse selon laquelle l'exposition à l'ocytocine synthétique, à des niveaux élevés, pendant la période périnatale peut avoir des effets sur la progéniture4.
Les études sur les conséquences à long terme de l'exposition à l'ocytocine périnatale chez les enfants sont moins nombreuses. Cependant, les auteurs ont récemment rapporté - sur la base d'une étude menée à New York sur 3000 nourrissons à terme - que les nourrissons traités par Pitocin® présentaient une augmentation d’effets indésirables multiples, y compris des réductions des scores Apgar (augmentation du pouls), et une augmentation de l'admission en soins intensifs(58) . L'augmentation des admissions en soins intensifs et d'autres effets indésirables, avec une augmentation de morbidité estimée à 30% de la morbidité, ont également été observés dans une étude australienne 2012(59) . Le risque neurodéveloppemental pour la progéniture a été estimé par des troubles déficitaires de l'attention deux fois plus fréquents des enfants exposés à Pitocin® pendant leur naissance(60) .
Plusieurs études ont associé l'exposition à l'ocytocine synthétique aux réductions de l’allaitement et à une altération des comportements alimentaires chez le nouveau-né (56),(61) . Ces études accumulant les preuves chez l’animal, soulignent la nécessité de poursuivre les recherches sur les résultats comportementaux à court terme de l'exposition à l'ocytocine synthétique dans la période périnatale du petit humain.
CONCLUSION
L'ocytocine est une hormone neuroendocrine avec des actions complexes dans tout le corps, des effets vitaux pour le couple mère/nourrisson et le bien-être social. Il reste encore beaucoup à comprendre sur le rôle joué par l'ocytocine dans la transition vers la maternité. Cependant, la recherche émergente à la fois chez les animaux et les modèles humains met en évidence la nécessité d'une meilleure compréhension du rôle de la naissance physiologique dans le comportement mère-enfant avec des conséquences importantes pour les disciplines obstétricales.
De toute évidence, le rôle de l'ocytocine dans le corps s'étend, bien au-delà de la contractilité utérine, jusqu’aux systèmes moléculaires cellulaires avec des conséquences potentielles à long terme. Les effets moléculaires en aval de l'ocytocine naturelle et de l'ocytocine synthétique n'ont pas fait l'objet d'études approfondies chez la femme et l’enfant. Les sages-femmes et la recherche obstétrique devraient considérer le système d'ocytocine comme un tout, et ne pas seulement se concentrer sur le résultat clinique immédiat.
Les questions abondent sur les implications à long terme du système de l'ocytocine pendant l'accouchement - une fenêtre de temps brève et complexe pour la mère et le nourrisson. Un exemple pourrait être l'identification précoce des femmes à risque de troubles de l'humeur post-partum ou de difficultés d’allaitement. L'identification des femmes à risque pourrait potentiellement provenir du génotype OTR, de l'épigénotype OTR et d’études différentielles de l’impact de la naissance sur la régulation de l'ocytocine endogène.
Bien que de nombreuses questions de base restent en suspens, les obstétriciens pourraient bénéficier d'une appréciation des conséquences moléculaires, développementales et comportementales de l'un des médicaments les plus largement utilisés en pratique obstétricale. Étant donné le manque de clarté sur les effets de l'ocytocine au-delà du travail, les professionnels de santé doivent s’impliquer dans la connaissance de ses processus de régulation conservé par l’évolution. Il y a un grand potentiel de collaboration interdisciplinaire pour que l'utilisation omniprésente de l'ocytocine synthétique en obstétrique moderne puisse se poursuivre.
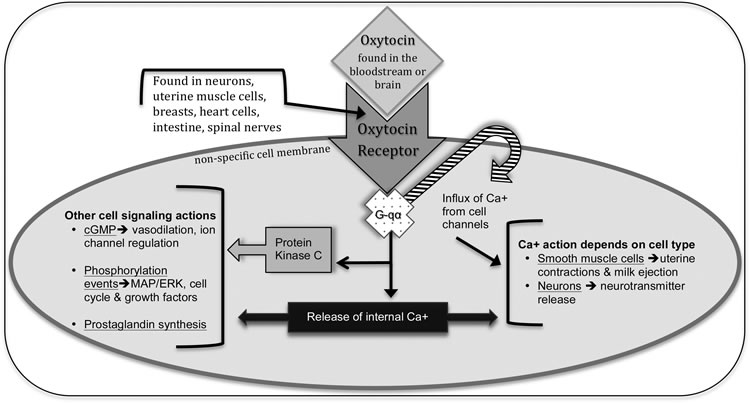
Figure 1
Traduction : Luc Perino
Bibliographie
Bell AF, Erickson EN, Carter CS
Beyond labor : the role of natural and synthetic oxytocin in the transition to motherhood
J Midwifery Womens Health. 2014 January ; 59(1): 35–42
DOI : 10.1111/jmwh.12101
Références numérotées dans le texte
(1) Martin, JA.; Hamilton, BE.; Ventura, SJ.; Osterman, MJK.; Wilson, TJ.; Mathews, T. Births: Final
data for 2010. In: Reports NVS. , editor. Hyatttsville, MD: National Center for Health Statistics; 2012.
(2) Declercq, ER.; Sakala, C.; Corry, MP. Listening to mothers II: report of the second national U.S. survey of women's childbearing experiences. New York: Childbirth Connection; 2006. Executive summary.
(3) Neumann ID, Landgraf R. Balance of brain oxytocin and vasopressin: implications for anxiety, depression, and social behaviors. Trends Neurosci. 2012; 35(11):649–659. [PubMed: 22974560]
(4) Carter CS, Boone EM, Pournajafi-Nazarloo H, Bales KL. Consequences of early experiences and exposure to oxytocin and vasopressin are sexually dimorphic. Dev Neurosci. 2009; 31(4):332–341. [PubMed: 19546570]
(5) Brunton PJ, Russell JA. Endocrine induced changes in brain function during pregnancy. Brain Res. 2010; 1364:198–215. [PubMed: 20869351]
(6) Brunton PJ, Russell JA. The expectant brain: adapting for motherhood. Nat rev Neurosci. 2008; 9(1):11–25. [PubMed: 18073776]
(7) Gimpl G, Fahrenholz F. The oxytocin receptor system: structure, function, and regulation. Physiol Rev. 2001; 81(2):629–683. [PubMed: 11274341]
(8) Devost D, Wrzal P, Zingg HH. Oxytocin receptor signalling. Prog Brain Res. 2008; 170:167–176. [PubMed: 18655881]
(9) Arias F. Pharmacology of oxytocin and prostaglandins. Clin Obstet Gynecol. 2000; 43(3):455–468. [PubMed: 10949750]
(10) Perry RL, Satin AJ, Barth WH, Valtier S, Cody JT, Hankins GD. The pharmacokenetics of oxytocin as they apply to labor induction. Am J Obstet Gynecol. 1996; 174(5):1590–1593. [PubMed: 9065134]
(11) White-Traut R, Watanabe K, Pournajafi-Nazarloo H, Schwertz D, Bell A, Carter CS. Detection of salivary oxytocin levels in lactating women. Dev Psychobiol. 2009; 51(4):367–373. [PubMed: 19365797]
(12) Israel JM, Poulain DA, Oliet SH. Oxytocin-induced postinhibitory rebound firing facilitates bursting activity in oxytocin neurons. J Neurosci. 2008; 28(2):385–394. [PubMed: 18184781]
(13) Neumann ID, Torner L, Toschi N, Veenema AH. Oxytocin actions within the supraoptic and paraventricular nuclei: differential effects on peripheral and intranuclear vasopressin release. Am J Physiol Regul Integr Comp Physiol. 2006
(14) Churchland PS, Winkielman P. Modulating social behavior with oxytocin: how does it work? What does it mean? Horm Behav. 2012; 61(3):392–399. [PubMed: 22197271]
(15) Ermisch A, Barth T, Ruhle HJ, Skopkova J, Hrbas P, Landgraf R. On the blood-brain barrier to peptides: accumulation of labelled vasopressin, DesGlyNH2-vasopressin and oxytocin by brain regions. Endocrinol Exp. 1985; 19(1):29–37. [PubMed: 3872788]
(16) Khazipov R, Tyzio R, Ben-Ari Y. Effects of oxytocin on GABA signalling in the foetal brain during delivery. Prog Brain Res. 2008; 170:243–257. [PubMed: 18655887]
(17) McEwen BB. Brain-fluid barriers: relevance for theoretical controversies regarding vasopressin and oxytocin memory research. Adv Pharmacol. 2004; 50:531–592. 655–708. [PubMed: 15350270]
(18) Uvnas-Moberg K. Role of efferent and afferent vagal nerve activity during reproduction: integrating function of oxytocin on metabolism and behaviour. Psychoneuroendocrinology. 1994; 19(5–7):687–695. [PubMed: 7938364]
(19) Jonas K, Johansson LM, Nissen E, Ejdeback M, Ransjo-Arvidson AB, Uvnas-Moberg K. Effects of intrapartum oxytocin administration and epidural analgesia on the concentration of plasma oxytocin and prolactin, in response to suckling during the second day postpartum. Breastfeed Med. 2009; 4(2):71–82. [PubMed: 19210132]
(20) Kimura T, Saji F, Nishimori K, Ogita K, Nakamura H, Koyama M, et al. Molecular regulation of the oxytocin receptor in peripheral organs. J Mol Endocrinol. 2003; 30(2):109–115. [PubMed:12683935]
(21) Phaneuf S, Rodriguez Linares B, TambyRaja RL, MacKenzie IZ, Lopez Bernal A. Loss of myometrial oxytocin receptors during oxytocin-induced and oxytocin-augmented labour. J Reprod Fertil. 2000; 120(1):91–97. [PubMed: 11006150]
(22) Heim C, Binder EB. Current research trends in early life stress and depression: Review of human studies on sensitive periods, gene-environment interactions, and epigenetics. Exp Neurol. 2012; 233(1):102–111. [PubMed: 22101006]
(23) Szyf M, McGowan P, Meaney M. The social environment and the epigenome. Environ Mol Mutagen. 2008; 49(1):46–60. [PubMed: 18095330]
(24) Kumsta R, Hummel E, Chen FS, Heinrichs M. Epigenetic regulation of the oxytocin receptor gene: implications for behavioral neuroscience. Front Neurosci. 2013; 7:83. [PubMed: 23734094]
(25) Gregory SG, Connelly JJ, Towers AJ, Johnson J, Biscocho D, Markunas CA, et al. Genomic and epigenetic evidence for oxytocin receptor deficiency in autism. BMC Med. 2009; 7:62. [PubMed:19845972]
(26) Connelly, JJ.; Kenkel, W.; Erickson, E.; Carter, CS. Society for Neuroscience. Washington D.C.: 2011. Are birth and oxytocin epigenetic events?
(27) Carter CS, Altemus M, Chrousos GP. Neuroendocrine and emotional changes in the post-partum period. Prog Brain Res. 2001; 133:241–249. [PubMed: 11589134]
(28) Altemus M, Redwine LS, Leong YM, Frye CA, Porges SW, Carter CS. Responses to laboratory psychosocial stress in postpartum women. Psychosom Med. 2001; 63(5):814–821. [PubMed:11573030]
(29) O'Hara MW, McCabe JE. Postpartum depression: current status and future directions. Annu Rev Clin Psychol. 2013; 9:379–407. [PubMed: 23394227]
(30) Shin H, Park YJ, Ryu H, Seomun GA. Maternal sensitivity: A concept analysis. J Adv Nurs. 2008; 64(3):304–314. [PubMed: 18764848]
(31) Beck CT. The effects of postpartum depression on maternal-infant interaction: A meta-analysis. Nurs Res. 1995; 44(5):298–304. [PubMed: 7567486]
(32) Kingston D, Tough S, Whitfield H. Prenatal and postpartum maternal psychological distress and infant development: a systematic review. Child Psychiatry Hum Dev. 2012; 43(5):683–714. [PubMed: 22407278]
(33) Blom EA, Jansen PW, Verhulst FC, Hofman A, Raat H, Jaddoe VW, et al. Perinatal complications increase the risk of postpartum depression. The Generation R Study. BJOG. 2010; 117(11):1390–1398. [PubMed: 20682022]
(34) Waldenstrom U, Hildingsson I, Rubertsson C, Radestad I. A negative birth experience: Prevalence and risk factors in a national sample. Birth. 2004; 31(1):17–27. [PubMed: 15015989]
(35) Sakala, C.; Corry, M. Evidence-based maternity care: What it is and what can be achieved. New York: Childbirth Connections, Reforming States Group, and Milbank Memorial Fund; 2008.
(36) Bartz JA, Zaki J, Bolger N, Ochsner KN. Social effects of oxytocin in humans: context and person matter. Trends Cogn Sci. 2011; 15(7):301–309. [PubMed: 21696997]
(37) Yan HC, Cao X, Das M, Zhu XH, Gao TM. Behavioral animal models of depression. Neuroscience bulletin. 2010; 26(4):327–337. [PubMed: 20651815]
(38) Amico JA, Mantella RC, Vollmer RR, Li X. Anxiety and stress responses in female oxytocin deficient mice. J Neuroendocrinol. 2004; 16(4):319–324. [PubMed: 15089969]
(39) Bosch OJ, Meddle SL, Beiderbeck DI, Douglas AJ, Neumann ID. Brain oxytocin correlates with maternal aggression: link to anxiety. J Neurosci. 2005; 25(29):6807–6815. [PubMed: 16033890]
(40) Cyranowski JM, Hofkens TL, Frank E, Seltman H, Cai HM, Amico JA. Evidence of dysregulated peripheral oxytocin release among depressed women. Psychosom Med. 2008; 70(9):967–975. [PubMed: 19005082]
(41) Skrundz M, Bolten M, Nast I, Hellhammer DH, Meinlschmidt G. Plasma oxytocin concentration during pregnancy is associated with development of postpartum depression. Neuropsychopharmacology. 2011; 36(9):1886–1893. [PubMed: 21562482]
(42) Boccia ML, Goursaud AP, Bachevalier J, Anderson KD, Pedersen CA. Peripherally administered non-peptide oxytocin antagonist, L368,899, accumulates in limbic brain areas: a new pharmacological tool for the study of social motivation in non-human primates. Horm Behav. 2007; 52(3):344–351. [PubMed: 17583705]
(43) Keverne EB, Kendrick KM. Oxytocin facilitation of maternal behavior in sheep. Ann N Y Acad Sci. 1992; 652:83–101. [PubMed: 1385685]
(44) Pedersen CA, Caldwell JD, Walker C, Ayers G, Mason GA. Oxytocin activates the postpartum onset of rat maternal behavior in the ventral tegmental and medial preoptic areas. Behav Neurosci. 1994; 108(6):1163–1171. [PubMed: 7893408]
(45) Holman, SD.; Goy, RW. Experiential and hormonal correlates of care-giving in rhesus macaques. In: Pryce, CR.; Martin, RD.; Skuse, D., editors. Motherhood in Human and Nonhuman Primates: Biosocial Determinants. Switzerland: Karger; 1995.
(46) Williams GL, Gazal OS, Leshin LS, Stanko RL, Anderson LL. Physiological regulation of maternal behavior in heifers: Roles of genital stimulation, intracerebral oxytocin release, and ovarian steroids. Biol Reprod. 2001; 65(1):295–300. [PubMed: 11420252]
(47) Bales K, van Westerhuyzen J, Lewis-Reese A, Grotte N, Lanter J, Carter C. Oxytocin has dosedependent developmental effects on pair-bonding and alloparental care in female prairie voles. Horm Behav. 2007; 52(2):274–279. [PubMed: 17553502]
(48) Hayes U, De Vries G. Role of pregnancy and parturition in induction of maternal behavior in prairie voles (Microtus ochrogaster). Horm Behav. 2007; 51(2):265–272. [PubMed: 17174957]
(49) Bakermans-Kranenburg MJ, van Ijzendoorn MH. Oxytocin receptor (OXTR) and serotonin transporter (5-HTT) genes associated with observed parenting. Soc Cogn Affect Neurosci. 2008;3(2):128–134. [PubMed: 19015103]
(50) Gordon I, Zagoory-Sharon O, Leckman JF, Feldman R. Oxytocin and the development of parenting in humans. Biol Psychiatry. 2010; 68(4):377–382. [PubMed: 20359699]
(51) Francis DD, Young LJ, Meaney MJ, Insel TR. Naturally occurring differences in maternal care are associated with the expression of oxytocin and vasopressin (V1a) receptors: Gender differences. J Neuroendocrinol. 2002; 14(5):349–353. [PubMed: 12000539]
(52) Feldman R, Zagoory-Sharon O, Weisman O, Schneiderman I, Gordon I, Maoz R, et al. Sensitive parenting is associated with plasma oxytocin and polymorphisms in the OXTR and CD38 genes. Biol Psychiatry. 2012; 72(3):175–181. [PubMed: 22336563]
(53) Atzil S, Hendler T, Feldman R. Specifying the neurobiological basis of human attachment: brain, hormones, and behavior in synchronous and intrusive mothers. Neuropsychopharmacology. 2011; 36(13):2603–2615. [PubMed: 21881566]
(54) Feldman R, Gordon I, Zagoory-Sharon O. Maternal and paternal plasma, salivary, and urinary oxytocin and parent-infant synchrony: considering stress and affiliation components of human bonding. Dev Sci. 2011; 14(4):752–761. [PubMed: 21676095]
(55) Wiklund I, Norman M, Uvnas-Moberg K, Ransjo-Arvidson AB, Andolf E. Epidural analgesia: breast-feeding success and related factors. Midwifery. 2009; 25(2):e31–e38. [PubMed: 17980469]
(56) Olza Fernandez I, Marin Gabriel M, Malalana Martinez A, Fernandez-Canadas Morillo A, Lopez Sanchez F, Costarelli V. Newborn feeding behaviour depressed by intrapartum oxytocin: a pilot study. Acta Paediatr. 2012; 101(7):749–754. [PubMed: 22452314]
(57) Rault JL, Carter CS, Garner JP, Marchant-Forde JN, Richert BT, Lay DC Jr. Repeated intranasal oxytocin administration in early life dysregulates the HPA axis and alters social behavior. Physiol Behav. 2013; 112–113:40–48.
(58) Tsimis, MS.; Buckley, AP.; Nero, D.; Laurio, A. Oxytocin usage for labor induction or augmentation and adverse neonatal outcomes. American College of Obstetricians and Gynecologists 61st Annual Clinical Meeting; New Orleans, LA. 2013.
(59) Buchanan SL, Patterson JA, Roberts CL, Morris JM, Ford JB. Trends and morbidity associated with oxytocin use in labour in nulliparas at term. Aust N Z J Obstet Gynaecol. 2012; 52(2):173–178. [PubMed: 22384940]
Et pour aller plus loin
Choisissez de recevoir régulièrement
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
RARE
Site médical sans publicité
et sans conflit d'intérêts.
Vous aimerez aussi...
Sélection de la longévité humaine. - La longévité de l’homme a longtemps été considérée comme non soumise aux [...]
La mutation qui protège des maladies à prions - Un cas pratique d'évolution darwinienne a pu être mis en évidence dans une tribu de [...]
Évolution de la spermatogenèse chez les mammifères - Évolution moléculaire de la spermatogenèse chez les mammifères Le testicule produit des [...]
Épigénétique de la maltraitance - On sait que la maltraitance dans l’enfance augmente le risque de psychopathologie. Parmi les [...]
La maladie de Gaucher protège contre la tuberculose - Importance La maladie de Gaucher est une maladie héréditaire récessive dans laquelle les [...]
Vous aimerez aussi...
Mutation et sélection des cellules-souche tissulaires comme cause de vieillissement - Il existe une littérature abondante sur l'évolution et le vieillissement destinée à expliquer [...]
Variations ethniques pour la lipoprotéine (a) - Découverte en 1963, la lipoprotéine (a) ou Lp (a) a une structure proche de celle de la [...]
Nouvelles espèces issues de cancers transmissibles - Introduction Les chercheurs s'accordent à dire que c'est peu probable, mais les cancers [...]
Cholestyramine contre antibiorésistance - L'un des principaux défis de la gestion des antibiotiques est de déterminer comment utiliser les [...]
Perte de gènes et complexité - En perdant des gènes, la vie a souvent évolué vers une complexité accrue Des études majeures [...]
La phrase biomédicale aléatoire
Il devient honteux de s'accrocher au-delà d'un certain point. Ne pas étirer indûment le fil de la vie. Faire le choix le plus noble. Ainsi pensait Aristote.
― Samuel Bellow
Vous aimerez aussi ces humeurs...
Déclin de la transcendance - La neurophysiologie fascine par ses progrès fulgurants et agace par sa prétention à percer [...]
Plaisir mathématique et clinique élémentaire - Toute analyse biologique comporte un pourcentage de résultats erronés de deux types : soit [...]
Le bon critère - La définition de tout objet de science (planète, espèce, tempête ou pauvreté) repose sur [...]
Crise des urgences - Les urgences connaissent une crise sans précédent dont la cause, très prévisible, est [...]
Épiques équipées coronaires - Le cœur des humains semble trop gros pour les fines artères chargées de l’irriguer. Ces [...]
