Renégociation du dilemme obstétrical
dernière mise à jour le 13/02/2021
Entre Charybde et Scylla, la renégociation du « dilemme obstétrical » en réponse aux changements environnementaux
Abstract
L’hominisation a vu l'émergence de deux traits: la bipédie et l'encéphalisation qui sont fondamentalement liés par le problème du passage de la tête du fœtus à travers le bassin maternel à la naissance ; un scénario appelé «dilemme obstétrical». Alors que les explications adaptatives de la bipédie et des gros cerveaux parlent du phénotype adulte, ce sont les croissances du cerveau et du bassin qui sont soumis au dilemme obstétrical. De nombreuses populations contemporaines connaissent des problèmes de périnatalité liés à l’obstruction du travail, confirmant que le dilemme obstétrical n'est pas corrigé et qu’il est affecté par des changements écologiques. Certaines tendances environnementales peuvent affecter la croissance du bassin et du cerveau chez les enfants à des degrés divers, alors que ces deux caractéristiques diffèrent d'une génération au moment de leur lien et de leur expression. Deux questions clés se posent : comment l'ajustement entre le bassin maternel et le cerveau de la progéniture sont «renégociés» lors des changements environnementaux et quels signaux nutritionnels et de croissance régulent ce processus ? Je prétends que le potentiel de modification de la taille maternelle entre générations empêche que le poids de naissance soit sous forte influence génétique. Au contraire, la croissance du fœtale s’adapte au phénotype maternel, ce qui permet de limiter le conflit écologique à court terme. Néanmoins, les rapides changements nutritionnels entre générations peuvent provoquer des antagonismes entre les traits maternels et infantiles et augmenter les risques au moment du travail.
1 - Introduction
La locomotion bipède est une caractéristique déterminante des hominines, bien que son anatomie ait varié au fil du temps [1]. Le genre Homo a, de plus, un cerveau de grande taille. Étant donné que ces traits existent depuis des millions d'années, ils ont logiquement été fortement favorisés par d’anciennes pressions sélectives [2,3], mais ces avantages adaptatifs restent encore sujets à débats. Comprendre leur émergence est essentiel pour la compréhension de l'histoire à long terme de notre propre espèce. D’autant plus que ces deux traits sont fondamentalement liés : la tête néonatale doit passer au travers du bassin maternel à la naissance. Pendant des décennies, le problème de cette interaction a été nommé «dilemme obstétrical» [4] et a été largement attribué à des pressions sélectives contrastées agissant sur la locomotion et la taille du cerveau, favorisant une grosse tête néonatale par rapport aux dimensions du bassin maternel [4,5,6].
Il ne fait aucun doute que la structure pelvienne a considérablement changé dans l’histoire évolutive des hominines et que l'ajustement serré entre ses dimensions et celles du cerveau de sa progéniture se reflète dans un processus de naissance inhabituellement complexe des humains contemporains, décrit avec élégance par Trevathan et ses collaborateurs [5, 6]. L’accouchement est plus long dans notre espèce que chez les primates non humains, et le fœtus doit subir une rotation lors du passage par le bassin. Les parturientes bénéficient souvent d’une assistance pour minimiser le risque de blessure chez le nouveau-né, bien que des naissances solitaires puissent se produire. Pour faciliter l’accouchement, la tête du fœtus est compressible, et le pelvis peut se dilater un peu [7]. Collectivement, donc, ces traits représentent une «résolution» générique du dilemme obstétrical, mais dans les populations contemporaines, cette résolution semble souvent partielle. En effet, de nombreuses populations humaines contemporaines connaissent de forts niveaux de mortalité maternelle et néonatale, en raison du travail bloqué qui représente environ 12% du fardeau mondial total de la mortalité maternelle, ainsi qu’une part importante de la mortalité périnatale [8,9]. Au-delà des risques immédiats de déchirures ou fistules chez la mère, il existe aussi des conditions incontinences urinaires tardives. Ainsi, comme discuté par Arrowsmith et al. [10], "les femmes qui ont vécu un travail long et obstrué, présentent souvent de sérieux problèmes sociaux, dont le divorce, l'exclusion des activités religieuses, la séparation de leurs familles, l’aggravation de la pauvreté, la malnutrition et des souffrances presque insupportables ". Reconnaissant la charge de morbidité et de mortalité du travail obstrué, Krogman a décrit en 1951 la naissance humaine comme une «cicatrice» de notre histoire évolutive [11].
Il convient toutefois de considérer si ce dilemme obstétrical a été uniforme dans l'évolution des hominines sur le long terme, ou si le risque de travail obstrué a été exacerbé par des évolutions comportementales et biologiques récentes. Il est de plus en plus reconnu que beaucoup de traits des hominines ont une histoire évolutive en mosaïque complexe [12] . Par exemple, la manifestation de la locomotion bipède a changé entre les premiers et les derniers hominines1, et l’encéphalisation s’est étalée progressivement sur 2 millions d’année dans le genre Homo7. L'ampleur du dilemme obstétrical doit donc avoir changé aussi. Conformément à cette hypothèse, les Australopithèques et les humains archaïques semblent avoir eu un degré plus élevé de disproportion céphalo-pelvienne que Homo erectus [7] . Au cours des dernières cent milles années, la taille du corps et la capacité crânienne ont changé de façon contrastée dans le genre Homo, comme illustré figure 1 [13]. De même, peu de biologistes ignorent les rapides changements de taille de corps qui se sont produits ces derniers siècles, où de nombreuses populations sont devenues à la fois plus grandes et plus lourdes [14,15].

Figure 1. Les tendances séculaires de la masse corporelle (a) et la capacité crânienne (b) chez les adultes au cours des 1,2 derniers millions d’années dans le genre Homo. Les tendances ne correspondent pas, indiquant que la relation entre la masse corporelle chez l'adulte et la taille du cerveau a changé au cours de cette période. Cela suggère que le dilemme obstétrical peut aussi avoir subi une renégociation pendant la même période. Adapté de Ruff et al. [13].
Bien que ces tendances de poids et de taille soient généralement décrites sur des données chez l’adulte, elles ont également des implications pour le dilemme obstétrical, et dans ce contexte l'importance relative de la bipédie dans le dilemme obstétrical est à reconsidérer. Une autre perspective est de considérer que l'ampleur de la croissance du fœtus n'est pas limitée par l’anatomie locomotrice maternelle, mais par le métabolisme maternel devenu incapable de supporter une gestation plus longue d’une progéniture à grand cerveau [16]. Cependant, cette hypothèse n’explique pas l’obstruction du travail, pour lequel le facteur clé de risque est la croissance du fœtus au-delà d’une taille optimale pour l’accouchement. Un autre argument est que les deux traits, taille du cerveau et du pelvis, changent selon les générations, en réponse à l’environnement, et cette discordance exacerberait l’obstruction du travail [7].
L'objectif de cette revue est de développer cette dernière perspective plus en détail, en se concentrant sur une question spécifique : comment taille et la forme des corps évoluent en fonction des conditions écologiques, et comment l'ajustement entre la taille du bassin maternel et de la progéniture est-elle « renégociée » ?
2 - Résolution du dilemme par adaptation génétique
Le concept classique de l'adaptation darwinienne suppose que les organismes acquièrent les traits phénotypiques qui améliorent leur capacité de survivre et de se reproduire dans leur environnement habituel. Pour comprendre comment les dimensions squelettiques sont façonnées par les écosystèmes, nous pouvons considérer comment la croissance répond au climat.
Au XIXe siècle, par exemple, deux lois classiques ont été proposées concernant l'adaptation de la taille du corps et des formes aux contraintes climatiques. Bergmann [17] constate que la taille totale du corps dans les espèces à sang chaud augmente à mesure que les températures tombent, tandis qu’Allen [18] émet l'hypothèse que la taille des extrémités du corps diminuerait en conformité avec la théorie thermodynamique physique. Un nombre important de travaux ont ensuite soutenu ces hypothèses, tant chez les humains [19-23] que dans d'autres espèces [24-27]. Ces lois écologiques sont également largement utilisées pour interpréter l’évolution de la morphologie des hominines [28-30] et sont devenus influentes en anthropologie évolutive comme exemples d'une approche plus générale des capacités d'adaptation morphologique.
Compte tenu de la longue période d’évolution des hominines, ainsi que la large gamme de latitudes occupée par Homo sapiens, l'adaptation aux contraintes telles que la chaleur est largement supposée avoir eu lieu par des changements génétiques. La synthèse néo-darwinienne, consolidé dans les années 1940, a considéré que le changement phénotypique au cours du temps provient de l'accumulation de petits changements génétiques entraîné par le succès reproductif différentiel de quelques allèles par rapport aux autres [31]. Le statisticien Ronald Fisher a suggéré que la distribution normale des traits phénotypiques dépend de nombreux gènes exerçant chacun un petit effet, scénario désormais confirmé par les GWAS pour des indices corporels tels que la stature [32, 33]. Des variants génétique associés à la circonférence de la tête du nourrisson sont maintenant connus [34], alors que très peu d’informations sont disponibles pour les dimensions du bassin.
Le dilemme obstétrical pourrait donc être considéré comme la conséquence de deux traits contraints à un «compromis génétique», car chacun est exposé à l'autre au cours du processus de la naissance. Le dilemme contemporain pourrait être considéré comme le résultat à long terme de cette «négociation génétique», en optimisant les réponses à des pressions sélectives contrastées pour favoriser à la fois les cerveaux et une locomotion efficace, ensuite impactés par l’évolution de la taille du corps. Comme l'environnement a changé, et que divers modes de locomotion bipède et d'encéphalisation ont été sélectionnés, on peut supposer que l'ajustement entre la tête du nouveau-né et le bassin maternel s'est fait de façon adaptative.
Récemment, Grabowski [35] a exploré comment la capacité de changement évolutif d'un trait donné peut être régi par une sélection stabilisatrice au travers d’une suite de traits covariants. En relation avec le dilemme obstétrical, il a suggéré qu’un tel processus peut avoir réduit l'évolutivité globale du canal pelvien chez les hominines antérieurs, mais qu’il est devenu moins important chez les hominines ultérieurs. Une étude de la variabilité squelettique régionale dans les populations humaines récentes, a montré que le canal pelvien était, en fait, le trait le plus variable, suggérant que la sélection stabilisatrice n'est plus le processus dominant [36].
Bien qu'un tel changement génétique puisse être supposé avoir joué un rôle dans l'évolution du dilemme obstétrical, il semble également insuffisant pour expliquer le fardeau contemporain de la mortalité par travail entravé. Quelles que soient les pressions sélectives agissant sur l'encéphalisation et la locomotion des adultes, le dilemme obstétrical est, non seulement, la conséquence d'un conflit entre deux traits adultes, mais entre deux traits de développement : la croissance du bassin maternel et la croissance fœtale. Leur interaction au moment de la naissance rend complexe la résolution du dilemme, la sélection agissant non seulement sur les traits eux-mêmes, mais aussi sur leur coordination. De plus, la croissance maternelle se produit une génération avant la croissance de la progéniture, leur coadaptation aux contraintes écologiques prend la forme d'un «course à trois pattes» (figure 2), dans laquelle les deux traits sont liés sans possibilité d'une intégration phénotypique parfaite. 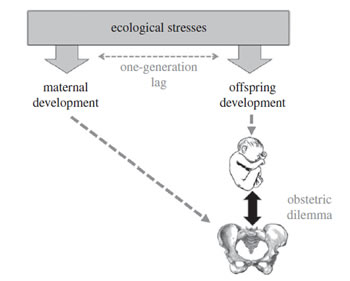
Figure 2. Schéma de principe illustrant la façon dont le dilemme obstétrical émerge de l'interaction entre deux traits, le bassin maternel et la taille néonatale de la progéniture, qui sont façonnés par des contraintes écologiques caractérisées
par un décalage temporel d'une génération au moment de leur exposition.
Nous devons avoir une meilleure idée des mécanismes non génétiques par lesquels le dilemme obstétricale peut être renégocié en réponse aux changements environnementaux. Nous pouvons donc plus précisément focaliser notre étude : à quels signaux écologiques répondent la croissance du bassin maternel et du fœtus, et comment leurs réponses adaptatives peuvent-elles être coordonnées étant donné qu'ils sont façonnés dans des périodes différentes?
3 - L’adaptation en tant que processus trans-générationnel
La notion selon laquelle la morphologie des adultes est déterminée par des trajectoires de croissance demande une réévaluation de la façon dont le phénotype répond aux contraintes écologiques. Pour donner un aperçu de ce processus, laissez-nous reconsidérer les distributions écogéographiques décrites par les lois de Bergmann et d'Allen. Contrairement à la notion de traits s'adaptant directement aux contraintes écologiques extérieures telles que le climat, il est maintenant clair que le processus d'adaptation commence dans l'utérus, ce qui signifie que beaucoup des contraintes clés agissant sur la progéniture sont médiées par un phénotype maternel [37, 38]. Par exemple, dans à travers les populations, le stress thermique et le poids à la naissance sont associés : le poids de naissance est inférieur dans des climats les plus chauds [39]. Alors que la mère elle-même est directement exposée à la chaleur, la perte de chaleur fœtale ne peut se produire qu’au travers des tissus maternels, d'où l'influence immédiate sur la thermodynamique fœtale du métabolisme maternel et de sa capacité homéostatique [40].
De façon plus générale, l'adaptation des traits de croissance doit donc être considéré comme un processus trans-générationnel, et le phénotype de chaque génération a déjà été exposé à des traits maternels avant que l'environnement extérieur lui-même ne soit connu. Comme le risque de mortalité est le plus important dans les premières années de vie [41], la manière dont le fœtus répond aux influences maternelles est cruciale pour la survie précoce. Le bassin et le cerveau sont soumis à contraintes dès le début du développement, bien avant que la cognition et la locomotion des adultes soient elles-mêmes exposées à des pressions sélectives.
Par exemple, Aiello & Wheeler [42] ont suggéré que les coûts métaboliques du gros cerveau d’Homo sapiens peuvent avoir été satisfaits en partie en diminuant l'investissement dans la masse intestinale par une amélioration de la qualité nutritionnelle. Puisque, en termes relatifs, les coûts énergétiques du cerveau sont plus grand en début de vie (environ 85% du métabolisme basal à la naissance, contre environ 25% chez l’adulte) [43], et puisque le cerveau adulte et la masse intestinale sont déterminés par des modèles de croissance, la nutrition infantile peut avoir exercé une pression sélective clé sur ce compromis. Les humains se caractérisent par l'utilisation d’«aliments de sevrage» permettant une «alimentation complémentaire» suite à l'allaitement maternel exclusif [44]. Ainsi, on constate que les contraintes écologiques agissant sur le développement du cerveau peuvent être très différentes de celles qui agissent sur la fonction cérébrale dans la vie adulte.
De plus, au-delà de tous les déterminants génétiques, il existe maintenant une preuve substantielle que la taille et les proportions du corps sont également caractérisés par la plasticité avant l'âge adulte et sont fortement liées aux expériences des débuts de la vie. Grâce à la plasticité du développement, les modèles de croissance sont soumis à des normes de réaction, et le phénotype adulte porte les traces du cumul de multiples contraintes développementales [45]. De classiques études chez les rats montrent que la variation de la nutrition en début de la vie exercé des effets de longue durée sur la taille et les proportions du corps [46,47]. Ces données sont cohérentes avec les observations chez les humains, en montrant que les variabilités de croissance précoce se poursuivent plus tard [48], le rachitisme dans l’enfance est connu pour contraindre et limiter la croissance du bassin [49].
En effet, la première période de plasticité de la croissance humaine comprend la vie fœtale et la petite enfance, et ces étapes de développement sont celles de la période de l’investissement maternel prépondérant. Le phénotype maternel est donc la principale source de signaux écologiques auxquels le développement de la progéniture s'adapte [37,38,50]. J'ai soutenu que ce chevauchement n'est pas une coïncidence, et que les traits de la progéniture maintiennent leur plasticité tant qu'ils restent sous le parapluie de la protection et de l’amortisseur maternel [37,51]. Lorsque ce tampon amortisseur disparaît (à la naissance pour certains traits et à la fin de l’allaitement maternel pour d'autres), de nombreux traits deviennent canalisés et constants au fil du temps. La taille absolue des composants du corps peut continuer à augmenter, mais les différences relatives entre les individus persistent.
Toute résolution renégociée du dilemme obstétrical est donc sensible à la régulation du développement de la progéniture par le phénotype maternel. Déjà aggravée par le décalage d’une génération entre la croissance maternelle et fœtale, la complexité de ce processus d'adaptation augmente encore lorsque nous considérons que les pressions sélectives agissant sur les deux parties ne sont pas identiques.
4 - L’adaptation en début de vie, comme un « tir à la corde »
La trajectoire de développement de chaque individu peut être vue à travers la lentille de la théorie de l'histoire de la vie, qui suppose que l'énergie est investie de manière optimale sur les fonctions concurrentes pour maximiser la survie précoce et la capacité reproductive de l'adulte [52]. Cependant, le processus de soins maternels (nutrition placentaire et allaitement) font cohabiter deux histoires de vie différentes, où la mère est exposée aux contraintes environnementales et le fœtus / nourrisson est exposé au phénotype maternel. Comme les mères et leurs descendants ne partagent que 50% de leurs gènes, les stratégies d'investissement maternel qui maximisent l'aptitude maternelle ne sont pas nécessairement identiques à celles qui maximisent la valeur sélective de la progéniture. Ce scénario conduit à ce que Trivers [53] a nommé « le conflit parent-progéniture » (parfois aussi nommé conflit fœto-maternel ou conflit social de la grossesse), relatif à l’allocation des ressources parentales pour l’ensemble des enfants et chacun d’eux.
Pour des non-mammifères, comme les oiseaux, le conflit parents/progéniture est clair lorsque les parents nourrissent leur progéniture [54], mais ce conflit a une acuité particulière dans le dilemme obstétrical parce que l'ampleur de l'investissement pendant la vie fœtale influe directement la taille à la naissance. Nous devons donc nous concentrer sur deux aspects de ce dilemme : la quantité d'énergie disponible à investir dans la progéniture par unité de temps, et la durée de la grossesse.
La notion de conflit parent-progéniture a été critiquée : par exemple, Bateson [55] a suggéré que les intérêts de la mère et de la progéniture étaient étroitement alignés. Cette critique ignore deux points clés. Tout d'abord, plutôt qu’un conflit direct, il s’agit d’un conflit lorsque la mère doit équilibrer ses investissements entre l’enfant en cours et les suivants. C'est là que le concept de négociation devient si important, comme démontré dans les études sur les interactions parents-progéniture chez les oiseaux [56]. Deuxièmement, en l'absence d'un tel conflit d'intérêts, il serait totalement impossible pour la progéniture sous le parapluie des soins maternels de s'adapter aux signaux écologiques. Moore & Haig [57] ont élégamment décrit le conflit parent-progéniture comme un « tir à la corde » sur l’ensemble des ressources maternelles potentiellement disponible pour l'investissement dans la progéniture. Haig [58] décrit comment les hormones du fœtus manipulent le métabolisme afin d'augmenter l'apport de nutriments par le placenta, et la réponse physiologique maternelle pour réduire le transfert de nutriments. Un « tir à la corde » similaire caractérise l’allaitement maternel [59]. Le même scénario s'applique à la durée de la gestation, qui introduit un autre axe de variabilité dans la résolution du dilemme obstétrical [60].
Le fœtus n'a pas d'exposition directe à l'environnement, donc il devient adapté par la tension appliquée par la physiologie maternelle dans ce « tir à la corde », et s'il n'y avait pas de tension, l'adaptation ne pourrait avoir lieu. Le fait que l'ajustement entre la tête néonatale et le bassin maternel soit aussi serré suggère que le « tir à la corde » autour de la taille à la naissance a été particulièrement combatif. Mais qu’est ce qui empêche chaque partie de «capituler» ?
5 - Pourquoi les enfants ne sont-ils pas plus petits ?
Reconnaissant que le dilemme obstétrical décrit de façon classique résulte de l'interaction d'une zone bidimensionnelle (le canal pelvien) et un volume tridimensionnel (la tête), Epstein [61] a calculé que même des augmentations très modérées du diamètre pelvien ou une diminution de la circonférence de tête néonatale rendrait le travail beaucoup plus facile. Ces valeurs se situent bien dans la gamme des variables populationnelles constatées dans les squelettes des archives archéologique [7,36]. Le paradoxe est donc que pour chaque nouveau-né dont la tête est contrainte pour traverser le bassin de sa mère, il existe des femmes au bassin plus large et des nouveau-nés à la tête plus petite qui auraient pu permettre un travail bien plus facile [7]. Qu'y a-t-il donc qui maintient une adaptation si serrée au sein des couples mère/enfant ?
La première question est la suivante : pourquoi la progéniture ne peut-elle pas être plus petite? À cet égard, la plus grande attention a porté sur les dimensions du cerveau de la progéniture. Chez le fœtus humain à terme, le cerveau a environ 30% de la taille du cerveau adulte[7]. Bien qu'il existe une plus grande variabilité chez les mammifères, ce pourcentage de 30% semble être le même chez tous les primates [62], suggérant que ce degré de développement du cérébral représente un minimum pour la viabilité d’un nourrisson primate [7]. En accord avec cette hypothèse, un raccourcissement systématique de la gestation des humains, qui serait une solution possible à la production de nouveau-nés à cerveau plus petits, semble être non viable : la figure 3 montre une forte association entre l'accouchement avant terme et la probabilité de dysfonctionnement cognitifs dans la vie ultérieure [63]. De toute évidence, la sélection a choisi 40 semaines pour la croissance du cerveau dans notre espèce, bien que la longueur de gestation soit encore variable dans et entre les populations.
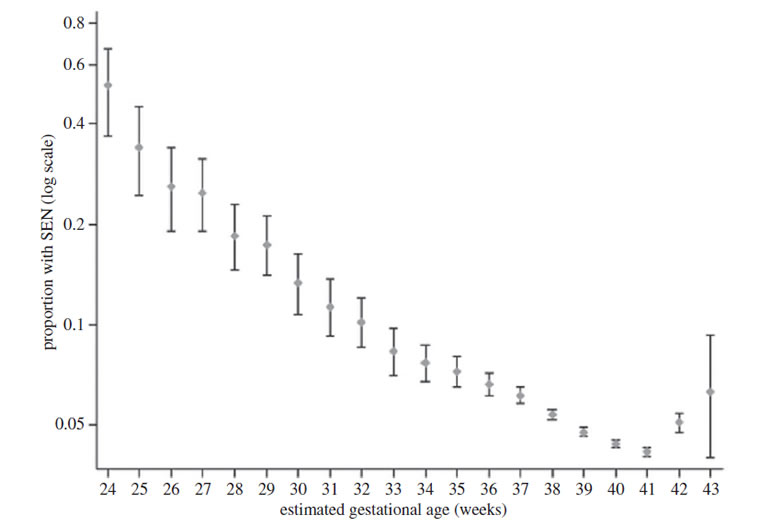
Figure 3. Prévalence de soins parentaux spéciaux (SEN : special education need) par l’âge de gestation à l'accouchement, montrant une association dose-réponse inversée, avec le niveau le moins élevé de préjudice pour les enfants nés à 41 semaines après la conception. Reproduit avec la permission de MacKay et al. [63].
Cependant, il est également trompeur de se concentrer uniquement sur les dimensions de la tête du fœtus. Une proportion importante de travail bloqué provient de difficultés liées au passage du corps, avec la dystocie de l'épaule est une des principales causes de blessures maternelles à la naissance (déchirements et hémorragie post-partum) et chez l’enfant (dégâts musculaires ou rachidiens) [7]. En réalité, ces difficultés ne sont pas propres aux humains et ont été observé chez d'autres primates [64, 65] et chez des mammifères [66]. Les analyses classiques de Leutenegger indiquent que les humains ne produisent pas des nouveau-nés exceptionnellement encéphalisés, mais plutôt des nouveau-né de poids élevé inattendu par rapport à la masse du corps maternel, et ces nouveau-nés plus lourds ont de gros cerveaux, mais pas de manière disproportionnée par rapport aux autres primates [67]. Une réanalyse plus complète de ces travaux suggère que Leutenegger a légèrement sous-estimé la magnitude de l'encéphalisation chez le nouveau-né humain, mais il est correct de conclure que l'augmentation de la masse néonatale est la principale caractéristique de notre espèce [7].
Nous devons donc examiner si la taille du corps, aussi bien que celle de la tête, pourraient être plus faible chez les nouveau-nés humains. De toutes les dimensions du nouveau-né, le coefficient de variation est le plus bas pour la circonférence de la tête et la taille (environ 30% du coefficient de variation du poids), alors qu'il est plus élevé pour les autres circonférences corporelles (environ 50-60%) et le plus grand pour l’épaisseur du pli cutané (environ 100%) [68]. Ces données indiquent une plus grande plasticité pour le poids et l'adiposité que pour la croissance linéaire du corps et la croissance du cerveau [69].
Les nouveau-nés pourraient donc être plus petits, réduisant ainsi l'ampleur du dilemme obstétrical, en réduisant les tissus non-cérébraux plus que le cerveau lui-même. Néanmoins, le poids à la naissance est le plus grand prédicteur de la survie en début de la vie [70]; donc toute réduction des tissus non cérébraux impose des pénalités de valeur sélective, indépendamment des pénalités cognitives associées à une gestation plus courte, comme précédemment décrit. Une étude récente a souligné la contribution de l'adiposité à la survie des nourrissons, en montrant que de faibles taux de leptine, l'hormone sécrétée par les tissus adipeux, étaient fortement associés au risque de mortalité chez les nourrissons africains malnutris [71]. Cela peut expliquer pourquoi, dans une comparaison des nourrissons pesant en moyenne approximativement 2,7 kg en Inde et environ 3,5 kg au Royaume-Uni, la différence de poids et de taille était d'environ 1,5 écarts-types z-scores, pour la circonférence de la tête, elle était d’environ 1,2 écarts types, mais de seulement 0.3 pour le pli cutané. La plus grande réduction était dans la circonférence abdominale (22,3), indiquant le sacrifice préférentiel des organes viscéraux [69,72].
Il semble donc qu'une gestation de 40 semaines soit sélectionnée pour une croissance optimale du cerveau dans notre espèce, et que les humains se distinguent également des autres espèces en produisant des nouveau-nés à corps relativement gros. Dans cette perspective, il est clair que la sélection favorise les fœtus qui développent de gros corps et de gros cerveaux, et si un compromis est nécessaire, la progéniture protège le cerveau au détriment d'autres organes et tissus, un phénomène connu sous le nom d’effet d’épargne cérébrale (BSE : Brain-Sparing Effect) [73,74]. Si la sélection a fortement favorisé la croissance fœtale, aurait-elle alors pu réduire la contrainte de l’accouchement en augmentant les dimensions du bassin maternel ?
6 - Pourquoi le pelvis maternel ne peut-il pas être plus grand ?
Il est maintenant clair qu'il existe une grande variabilité des dimensions pelviennes, résumées précédemment [7,36]. Le coefficient de variation est d'environ 7% pour l'axe antéro-postérieur et les diamètres transversaux de l'entrée pelvienne, et environ 11% pour le diamètre transversal de la sortie et approximativement 13,5% pour le diamètre antérieur-postérieur de sortie.
Cette variabilité est également associée à des variables écologiques. Plus particulièrement, il existe une forte association du diamètre bi-iliaque avec l'environnement thermique [7,75]. Cela indique que la locomotion n'est pas le seul facteur qui affecte la forme pelvienne, et que des dimensions pelviennes plus grandes n’empêchent pas l’efficacité de la locomotion. Comme on l'a vu au §3, le stress thermique est une contrainte établie sur la croissance et le physique, et des bassins étroits chez les populations exposées à des environnements chauds et humides sont un facteur plausible d'augmentation de la mortalité maternelle et périnatale dans les populations d'Afrique et d'Asie. Notamment, la gestation est légèrement plus courte chez les femmes d'Afrique et d'Asie du Sud par rapport aux femmes européennes [76-79]. Cela pourrait indiquer une modeste coadaptation fœtale à un plus petit canal pelvien chez les populations des pays chauds, mais bien que le stress thermique aigu ait été associé à la prématurité [80], il nous manque toujours des données sur les liens entre la durée moyenne de gestation et le climat.
Néanmoins, l'influence de l'environnement thermique sur les proportions pelviennes semble une explication incomplète de la variabilité dans les populations de la prévalence du travail obstrué, un facteur de risque clé dans diverses populations est une faible taille maternelle [81-83]. Dans les populations africaines caractérisées en moyenne par des pelvis étroits, ce sont les mères les plus petites qui présentent le risque le plus élevé. En d'autres termes, le bassin maternel pourrait être plus grand et le risque plus faible si elles avaient une meilleure croissance. Cela attire plutôt l'attention sur des contraintes écologiques supplémentaires affectant la croissance, notamment la nutrition.
En effet, la nutrition semble particulièrement pertinente pour le dilemme obstétrical, d'abord parce que les contraintes nutritionnelles ont un impact sur tous les groupes d'âge, deuxièmement parce que les tendances séculaires des tailles maternelles et fœtales sont maintenant bien décrites, et troisièmement, parce que l’énergie métabolique est la cible principale du tir à la corde entre mère et progéniture pendant la vie fœtale [57], dont le résultat est la taille à la naissance.
7 - Tendances séculaires de la taille corporelle
Il existe maintenant des données importantes sur les tendances séculaires de la taille des adultes dans de nombreuses populations, indiquant que le changement des conditions a une incidence sur les trajectoires de croissance. En Hollande, par exemple, la taille moyenne de la femme a augmenté d'environ 154 cm en 1840 À 171 cm en 1997, un gain moyen de 1,26 cm par décennie [84,85]. À leur tour, les augmentations de la taille féminine sont associées à des dimensions pelviennes plus importantes et un risque réduit de dystocie céphalo-pelvienne et de césarienne [81, 82,83,86,87]. Toutefois, bien que l’on ait accordé une attention particulière à l’augmentation de taille des populations européennes, des tendances négatives ont été observées dans de nombreuses populations. En Inde, par exemple, la taille a diminué de près de 20 cm en plus de 10 000 ans, une baisse attribuée aux impacts cumulés de l'origine de l'agriculture et de l’augmentation de densité de la population, et de l'exposition aux sécheresses régulières, aux famines et aux épidémies [38,88]. Une hausse très modeste de la taille des femmes a eu lieu en Inde au vingtième siècle [38].
Ce sont ces tendances négatives de taille adulte qui sont particulièrement importantes pour la coordination du phénotype maternel et de la progéniture, Car la progéniture doit nécessairement adapter sa stratégie de croissance à ces dimensions pelviennes réduites pour réussir naissance. Par exemple, les dimensions pelviennes des mères indiennes sont considérablement réduites par rapport à celles des Européennes [7,89]. Se concentrer sur ces tendances séculaires offre une nouvelle réflexion sur la façon dont le dilemme obstétrical doit être renégocié avec le temps.
La possibilité que les dimensions pelviennes maternelles puissent se réduire au fil des générations a des implications majeures pour les mécanismes de régulation de la croissance tardive du fœtus [90]. Si les influences sur la taille néonatale étaient à prédominance génétique, le risque de travail obstrué serait exacerbé au fur et à mesure du déclin de la stature maternelle. Alors que l'adaptation génétique pourrait en théorie se produire à travers la survie différentielle des génotypes des plus petit, cela se produirait au prix de lourdes charges de mortalité maternelle et infantile, et l'adaptation pourrait être trop lente pour assurer la survie de la lignée.
De là, nous pouvons faire deux prédictions: d'abord, que l'influence des facteurs génétiques sur le poids de naissance devrait être relativement faible, et deuxièmement, il devrait y avoir relativement peu de gènes exerçant un effet important sur le poids à la naissance, car leur présence constituerait un facteur de risque majeur pour l’accouchement des mères de petite taille. Ces deux hypothèses sont soutenues par des preuves.
Alors que le poids de naissance paternel, indépendant du poids maternel, est corrélé avec le poids de naissance de la progéniture [91], indiquant une contribution génétique paternelle, la proportion totale de variabilité de poids et taille de naissance attribuable aux facteurs génétiques est de seulement 30% [92,93]. Cette amplitude de variabilité est sensiblement inférieure à celle de l’adulte, approchant 90% [94]. La figure 4 illustre les changements d'héritabilité en poids et taille, entre la naissance et 3 ans, ainsi qu'une diminution de l'héritabilité de poids au cours du dernier trimestre de la grossesse - d'environ 50% à 25 semaines de gestation, à environ 30% à 42 Semaines [95]. Cette baisse de l'influence génétique au cours du dernier trimestre permet de réguler principalement la croissance tardive du fœtus par des facteurs maternels et utérins, avant que l'impact du génotype lui-même réapparaisse dans la vie postnatale.
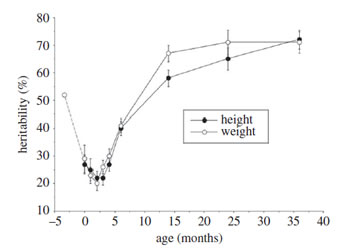 Figure 4. Estimations de l'héritabilité en poids et taille dans le registre des jumeaux aux Pays-Bas, avec ajout de données provenant d'une autre étude de fin de grossesse. L'héritabilité du poids diminue d'environ 50% à 25 semaines de gestation à environ 30% à la naissance, puis augmente à environ 70% à 36 mois. Le modèle post-natal pour la taille est très similaire. Adapté de [93,95].
Figure 4. Estimations de l'héritabilité en poids et taille dans le registre des jumeaux aux Pays-Bas, avec ajout de données provenant d'une autre étude de fin de grossesse. L'héritabilité du poids diminue d'environ 50% à 25 semaines de gestation à environ 30% à la naissance, puis augmente à environ 70% à 36 mois. Le modèle post-natal pour la taille est très similaire. Adapté de [93,95].
De même, même si un très petit nombre d'allèles augmentent le poids de naissance de 90 g ou 155 g pour les homozygotes de ce type d’allèles de ce type [96-98], de tels effets importants sont extrêmement rare, et l'augmentation se situe plutôt vers 20 ou 30 g [99]. Malgré les GWAS, on ne trouve pas plus d’effets génétiques sur le poids de naissance, ces 20 à 30 g résument donc toute la variabilité polygénique du poids de naissance. Finalement, l’empreinte génomique est un mécanisme qui réduit l'expression des gènes qui favorisent la croissance fœtale pour éviter le risque de dépasser la valeur des dimensions pelviennes maternelles [90].
Néanmoins, bien que les facteurs environnementaux suffisent à rendre compte de la grande variabilité de taille à la naissance, il est important de rappeler que ces effets reflètent les contraintes écologiques accumulées sur plusieurs générations, ce qui peut empêcher une résolution complète du dilemme obstétrical.
8 - Intégrer les signaux écologiques
Comme l'a décrit Haig [58], le fœtus manipule le métabolisme maternel pendant la grossesse pour augmenter l'offre de nutriments passant par le placenta, alors que la physiologie maternelle tente de supprimer ces effets. Dans ce tir à la corde [57], l'influence du phénotype maternel sur la croissance fœtale est bien établie. Par exemple, des taux réduits de croissance fœtale sont typiques des premiers-nés, montrant une pénétration incomplète des artères spiralées [100] chez les mères qui fument ou sont anémiées [101, 102] ou qui ont un faible indice de masse corporelle [103, 104].
Le tir à la corde met la progéniture en contact avec un phénotype maternel composite. Les influences sur le métabolisme maternel vont des immédiates (par exemple, paludisme en cours de grossesse), aux plus récentes (état nutritionnel maternel lors de la conception) et aux développementales (nutrition dans l'enfance de la mère) jusqu’aux transgénérationnelles (expérience fœtale de la mère). De plus, certaines influences nutritionnelles pendant la grossesse s’étendent sur deux générations [105], alors que le père peut également générer des effets épigénétiques sur les enfants par l'empreinte des spermatozoïdes [106] .Ceci reflète la complexité des influences nutritionnelles sur la croissance et le développement de chaque génération.
La niche de la grossesse présente donc un environnement métabolique stabilisé dans lequel le phénotype maternel intègre une grande variété de signaux écologiques à court et long terme [51]. Kaplan et ses collègues [107, 108] ont décrit les tissus somatiques comme un «capital incarné», représentant l'accumulation pendant le développement des ressources physiques pour l'investissement dans la reproduction. M'appuyant sur cette approche, j'ai parlé du signal global qui détermine le développement de la progéniture comme un capital maternel, défini comme «tout aspect du phénotype maternel, somatique ou comportemental, qui permet un investissement différencié dans la progéniture » [38]. Grâce à des traits physiques stables tels que le volume utérin, avec des systèmes homéostatiques régulant le métabolisme, le capital maternel permet « aux fluctuations à court terme d’être lissées pour fournir une meilleure qualité environnementale ", réduisant ainsi les contraintes écologiques à court terme [37]. Un tel tampon maternel est critique, d'abord parce que les humains semblent avoir évolué dans une niche écologique volatile [3.109], et deuxièmement parce que les premiers stades hyperplasiques de croissance sont les plus sensibles aux effets environnementaux [51]. Comme nous l'avons vu au § 5, il semble que le cerveau humain en particulier bénéficie d'une telle protection maternelle pendant les 40 premières semaines de vie après la conception.
Étant donné que de nombreux aspects du capital maternel reflètent leur propre développement, et donc les effets grand-mères, il y a donc des limites à une renégociation rapide du dilemme obstétrical, malgré la plasticité phénotypique. Comme l'a expliqué Haig [58], le tir à la corde sur l'investissement maternel est également médié par des facteurs paternels qui influencent les signaux hormonaux de la demande nutritionnelle émise par le fœtus. À tel point que la composante paternelle de la stratégie de croissance de la progéniture s'adapte aux contraintes écologiques, il doit aussi le faire à travers les effets transducteurs du phénotype maternel. La capacité des lignées à développer des trajectoires contrastées de croissance fœtale, incorporant des résolutions alternatives au dilemme obstétrical, est illustrée par les conséquences des unions interethniques.
9 - Quand deux mondes entrent en collision
L’étude du phénotype de la progéniture produite par deux parents dont les tailles du corps sont contrastées offre un aperçu unique de la mesure dans laquelle le dilemme obstétrical peut être résolu. Des études des influences maternelles et paternelles sur la croissance de la progéniture ont d'abord été faites chez les chevaux et le bétail [110-112], mais une approche similaire a récemment été appliquée aux humains grâce à l'analyse de la progéniture des unions interethniques. Les grandes différences ethniques de la taille du corps adulte sont supposées avoir émergé en plusieurs générations pour adapter la croissance à des conditions écologiques contrastées, y compris par modifications génétiques.
Parmi les populations contemporaines, une situation particulièrement remarquable est le contraste entre les Sud-Asiatiques et les Européens. Non seulement il y a une différence substantielle dans la taille moyenne des adultes [38,113], mais les Sud-Asiatiques sont également caractérisés par un faible niveau de masse maigre par rapport à la taille, et par un pelvis féminin plus petit [38,89,114]. Une comparaison de la progéniture des parents indiens et européens au Royaume-Uni a montré que la progéniture de deux parents indiens pesait approximativement 400 g de moins que la progéniture de deux parents européens. Une partie de cet effet pourrait être attribuée au phénotype maternel : les descendants de mères indiennes pesaient environ 150 g de moins que la progéniture des mères européennes si le père en chaque cas était européen et 250 g de moins si le père était Indien [115]. Ainsi, les mères indiennes au Royaume-Uni produisent clairement une descendance plus petite que les mères européennes, et leurs la taille réduite de leur corps est probablement l'une des principales causes.
Cependant, par rapport à la descendance de deux parents indiens, ceux de mère indienne et du père européen pesaient approximativement 240 g de plus, indiquant que l’influence de la mère indienne n'est pas absolue, mais peut être modérée par des effets paternels. De même, par rapport à la descendance de deux Européens, ceux de mère européenne et de père indien pesaient environ 100 g de moins, indiquant que l'effet du père indien doit réduire le poids de naissance de sa progéniture, même lorsque la nutrition maternelle était apparemment suffisante pour produire un plus gros bébé [115].
Cette étude indique que la composante paternelle de «stratégie de croissance indienne» s'est adaptée aux contraintes de la mère indienne, et compte tenu des dimensions pelviennes plus petites des femmes indiennes [89], le dilemme obstétrical peut représenter une des pressions sélectives pertinentes. Des études plus détaillées de nourrissons indiens et européens ont montré cette la taille de la tête est plus petite chez les nouveau-nés indiens, mais que les principales différences concernent les indices de masse maigre [72,116]. Il n'est pas encore clair que la contribution paternelle à la stratégie de croissance de la progéniture représente une adaptation génétique ou un effet épigénétique, mais son implication pour le dilemme obstétrical est claire. Dans un analyse interethnique, comparaison des Européens et des Asiatiques aux USA, un taux plus élevé d'accouchement par césarienne était évident pour les nouveau-nés de mère asiatique et de père européen en comparaison avec deux parents européens, alors qu'un tel risque ne se voyait pas en cas de mère européenne et de père asiatique [117].
Ces études fournissent des preuves convaincantes que des stratégies de croissance fœtale peuvent émerger en différentes populations, comme des solutions localement adaptées du dilemme obstétrical. Parce que ces stratégies représentent sur un processus de facteurs trans-générationnels, toujours séparés par un temps de retard d’une génération unique, ils ne peuvent pas immédiatement obtenir une coadaptation optimale à de nouveaux signaux nutritionnels, y compris ceux dérivant du capital maternel.
10 - Effets antagonistes des contraintes nutritionnelles
Les études sur les unions interethniques ont offert une nouvelle approche de l'ajustement serré entre les dimensions du nouveau-né, le bassin maternel et le potentiel de stress nutritionnel pour le risque élevé de travail obstrué. Les facteurs nutritionnels peuvent changer à court terme, générant potentiellement une disparité entre les dimensions du bassin et l'ampleur de la croissance fœtale. Par exemple, une contrainte nutritionnelle sur le développement maternel peut perturber la forme ainsi que la taille du bassin. Une mauvaise alimentation et une exposition limitée à la lumière du soleil ont provoqué le rachitisme chez beaucoup de femmes au cours de la révolution industrielle, conduisant à une augmentation des césariennes au début du vingtième siècle [7]. Un dysfonctionnement placentaire maternel, une maladie métabolique et des diètes lipidiques pendant la grossesse peuvent également perturber la croissance du fœtus [118]. Cependant, en raison d’un décalage d'une génération dans l'exposition entre les deux parties, les contraintes nutritionnelles affectant le développement du bassin de la mère peuvent être très différentes de celles qui ont un impact sur le développement fœtal, générant potentiellement des effets antagonistes sur les deux traits.
Sur une plus large échelle de temps, une telle exacerbation du dilemme obstétrical peut avoir eu lieu autour du moment de l'émergence de l'agriculture. Les données provenant de nombreuses populations montrent que la stature a eu tendance à diminuer pendant cette période [119]. Les régimes à forte teneur en céréales peuvent avoir augmenté la charge diététique de glucose et une augmentation de sa disponibilité pour la progéniture, alors que l'augmentation des maladies infectieuses peut avoir favorisé l’accumulation de graisses chez le fœtus au cours du dernier trimestre de grossesse [7]. Ces effets métaboliques ne peuvent pas encore être reconstruits en toute confiance, mais les archives géologiques de squelettes montrent des dimensions pelviennes et une taille réduites des populations méditerranéennes À partir de 9000 av. J.-C., avant de se rétablir, et il y a des indications sur une mortalité périnatale plus élevée dans les premières populations agricoles que chez les fourrageurs de l’holocène, suggérant un dilemme obstétrical exacerbé [7].
Une image plus détaillée émerge pour un scenario remarquablement similarité dans les populations contemporaines, conduit par des cycles économiques qui ont généré des tendances séculaires du poids et de la taille. Au cours de la seconde moitié du vingtième siècle, la taille des mères africaines, initialement augmentée, a décliné à partir des années 1970 en association avec la baisse du revenu par habitant, en conséquence des politiques structurelles d'ajustement économique [120]. Dans le sens inverse, l'exposition à des marchés alimentaires internationaux a majoré les taux d'obésité dans les populations urbaines africaines [121], avec des répercussions sur le métabolisme maternel. De manière cruciale, une faible taille maternelle et une obésité maternelle sont deux facteurs de risque de diabète gestationnel [122,123], ce qui peut conduire à une « macrosomie », c’est-à-dire des nouveau-nés anormalement gros. La macrosomie est associée à toutes les complications du dilemme obstétricien: hémorragie, travail prolongé, traumatisme périnéal chez la mère, dystocie de l'épaule, asphyxie, traumatisme de naissance et décès chez les descendants [124]. Ces tendances nutritionnelles contrastées - à la baisse pour la taille maternelle, à la hausse pour le poids maternel – vont logiquement alourdir le fardeau du dilemme obstétrical.
Plus généralement, la macrosomie est maintenant un important problème de santé publique dans de nombreuses populations à faible et moyen revenu. Pour les comparaisons entre populations, un seuil unique de poids de naissance pour catégoriser la macrosomie est inapproprié en raison des différences ethniques dans la gamme normale des poids de naissance. En utilisant une catégorisation au 90ème centile de la population, Koyanagi et al. [124] ont examiné la prévalence et les corrélats de la macrosomie dans 23 pays à revenu faible ou intermédiaire. Constamment, dans les pays d'Afrique, d'Asie et d'Amérique latine, les facteurs de risque concernaient des mères plus âgées, de grande taille, des descendants masculins, une obésité maternelle et un diabète maternel (figure 5a). La macrosomie était associée à un risque accru de césarienne, même après ajustement pour césarienne élective; cependant, ce risque a également été systématiquement augmenté chez les primipares comparées aux multipares. Les associations âge maternel, parité et genre du bébé avec le risque de macrosomie confirment que la stratégie d'investissement maternel varie selon le parcours reproductif conformément à la maximisation de l'aptitude à la reproduction.
Ces risques de macrosomie se traduisent directement par des taux élevés de morbidité et de mortalité maternelle, illustrés à la figure 5b. Il est intrigant, cependant, que le rapport de cote pour la morbidité et la mortalité périnatales ne dépassait guère l'unité en Afrique (OR 1,23, IC 95% 1,08, 1,42) et ne différait pas significativement de l'unité en Asie (1,04, IC 95% 0,90, 1,19) ou en Amérique latine (0,95, IC 95% 0,82, 1,10). Cela indique que les conséquences néfastes de la production de grands descendants concernent de façon disproportionnée la mère plutôt que sa progéniture [124], et cela a des implications supplémentaires sur la façon dont la sélection peut agir sur le dilemme obstétrical. Si c'est la mère qui paie le plus lourd tribut pour les gros enfants, en particulier pour les primipares, alors la sélection devrait agir plus fortement sur les facteurs maternels plutôt que sur facteurs qui entravent la croissance du fœtus.
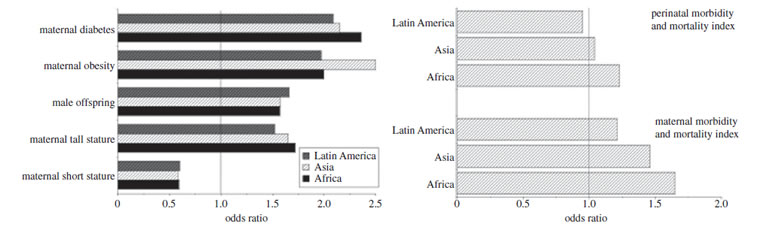
Figure 5. (a) Rapport de cotes pour donner naissance à des nourrissons macrosomiques (définis au-dessus du 90e centile du poids de naissance dans la population) en rapport avec la stature maternelle, l'obésité, le diabète, ainsi que le sexe de la progéniture, dans 23 pays. Les pays sont regroupés par région (Afrique, Asie, Amérique latine), démontrant des risques similaires. Les données ont été ajustées en fonction de l'âge maternel, de sa taille et de son statut métabolique et du sexe de la progéniture.
(b) Rapport de cotes pour la morbidité et la mortalité maternelle ou périnatale
en rapport avec des nouveau-nés macrosomiques. Les données ont été ajustées en fonction de l'âge maternel, de sa taille et de son statut métabolique et du sexe de la progéniture. Adapté de [124].
Cette perspective est soutenue par des études expérimentales, qui révèlent plus fortement l'effet des changements à court terme de l'approvisionnement énergétique maternel sur la taille de naissance de la progéniture. Des programmes de complément alimentaire, visant à réduire la prévalence du faible poids de naissance, ont contribué à une relativement modeste augmentation du poids de naissance. Par exemple, un essai randomisé en Gambie a montré que la supplémentation maternelle à partir de 20 semaines de gestation augmentait le poids de de 136 g en moyenne, bien que cet effet ait été plus important dans les saisons hors récolte (201 g), lorsque les mères avaient tendance à être plus légères, que dans les saisons de récolte (94 g) [125]. Cela illustre que l'effet de la supplémentation est médié par l'état maternel. Cependant, les mères supplémentées ont également normalisé leur fonction de reproduction plus rapidement que les mères non supplémentées, leur permettant de raccourcir le délai avant la grossesse suivante [126]. Cela montre que les mères conservent le contrôle prioritaire sur les «gains d'énergie» pendant la grossesse, et les convertissent principalement dans une taille de famille plus grande plutôt que par de plus gros bébés.
En effet, les tendances séculaires du poids à la naissance semblent se produire beaucoup plus lentement que ceux de la taille adulte. Alors que l'âge de maturité sexuelle et la taille des adultes peuvent changer au rythme d'un écart type par cinq à six générations, avec de telles tendances se poursuivant au fil des décennies, l'équivalent du taux de changement pour le poids à la naissance est généralement de 10 à 30 générations [127]. Un scénario similaire a été observé dans une étude longitudinale de macaques, où l'augmentation de l'offre de nutrition a augmenté immédiatement le poids maternel, mais a pris trois générations pour avoir un impact sur le poids de naissance [128]. Il est probable que le dilemme obstétrical agit comme une contrainte naturelle sur les changements séculaires du poids de naissance, et les risques pour la santé engendrés par la macrosomie indiquent que la contrainte a été dépassée.
11 - Conclusion
Dans cette étude, j'ai soutenu que l'ampleur du dilemme obstétrical n'est pas invariable, mais il reflète différentes "résolutions" qui ont émergé de l'impact des conditions écologiques sur les modèles de croissance. J'ai accordé une attention particulière au rôle de signaux nutritionnels contrastés dans la mise en application de cette résolution.
La taille maternelle peut varier d'une génération à l'autre en réponse à un changement écologique, la stratégie de croissance fœtale doit réduire sa dépendance génétique et plutôt répondre aux signaux du phénotype de la mère. Le tir à la corde sur l'investissement maternel permet l'adaptation fœtale, mais en réponse à la stratégie maternelle plutôt qu’à l'environnement en soi. Comme dans l’Odyssée, naviguant entre les monstres jumeaux Scylla et Charybde, le fœtus doit éviter deux périls : investir contre l’insuffisance nutritionnelle t (en particulier pour la croissance du cerveau) pour être viable en post-natal, et devenir trop gros pour une naissance réussie. Ce dilemme semble a été résolu par la progéniture qui a ajusté sa trajectoire de croissance sur les signaux métaboliques du phénotype maternel pour les dimensions du cerveau et du corps à ceux du bassin maternel.
Parce que cette correspondance représente une « négociation transgénérationnelle » composée d'un décalage temporel d'une génération entre les contraintes qui façonnent les modèles de croissance maternelle et de la progéniture, les stress nutritionnels à court terme peuvent le perturber, ce qui peut exacerber temporairement le dilemme obstétrique. Les femmes des pays à bas et moyen revenu ont subi une sous-alimentation pendant leur développement, mais sont maintenant exposés aux environnements obésogènes à l'âge adulte. Ce scénario exacerbe le dilemme obstétrical dans chaque direction, et contribue à des taux élevés de travail obstrué et à une épidémie de macrosomie. La nutrition en santé publique a donc des implications majeures pour le fardeau mondial de la mortalité maternelle. Il faut reconnaître que cela implique davantage l'ordre économique mondial, qui est un facteur clé contribuant à la fois à la sous-nutrition persistante (contraignant la croissance pelvienne chez les mères) et l’épidémie émergente d'obésité (promotion du gain de poids fœtal) [129].
Traduction : Luc Perino
Bibliographie
Wells JCK
Between Scylla and Charybdis: renegotiating resolution of the ‘obstetric dilemma’ in response to ecological change
Phil. Trans. R. Soc. B 370:20140067
DOI : 10.1098/rstb.2014.0067
Références numérotées dans le texte
1. Harcourt-Smith WE, Aiello LC. 2004 Fossils, feet and the evolution of human bipedal locomotion. J. Anat. 204, 403–416. (doi:10.1111/j.0021-8782.2004.00296.x)
2. Bonnefille R, Potts R, Chalie F, Jolly D, Peyron O. 2004 High-resolution vegetation and climate change associated with Pliocene Australopithecus afarensis. Proc. Natl Acad. Sci. USA 101, 12 125–12 129. (doi:10.1073/pnas.0401709101)
3. Potts R. 1996 Humanity‘s descent: the consequences of ecological instability. New York, NY: William Morrow & Co.
4. Washburn SL. 1960 Tools and human evolution. Sci. Am. 203, 63–75. (doi:10.1038/ scientificamerican0960-62)
5. Rosenberg K, Trevathan W. 2002 Birth, obstetrics and human evolution. BJOG 109, 1199–1206. (doi:10.1046/j.1471-0528.2002.00010.x)
6. Trevathan WR. 2011 Human birth: an evolutionary perspective. New Brunswick, Canada: AldineTransaction.
7. Wells JC, DeSilva JM, Stock JT. 2012 The obstetric dilemma: an ancient game of Russian roulette, or a variable dilemma sensitive to ecology? Am. J. Phys. Anthropol. 149(Suppl. 55), 40–71. (doi:10.1002/ ajpa.22160)
8. World Health Organization. 2006 Neonatal and perinatal mortality: country, regional and global estimates. Geneva, Switzerland: World Health Organization.
9. World Health Organization. 2005 World Health Report: make every woman and child count. Geneva, Switzerland: World Health Organization.
10. Arrowsmith S, Hamlin EC, Wall LL. 1996 Obstructed labor injury complex: obstetric fistula formation and the multifaceted morbidity of maternal birth trauma in the developing world. Obstet. Gynecol. Surv. 51, 568–574. (doi:10.1097/00006254-1996 09000-00024)
11. Krogman WM. 1951 The scars of human evolution. Sci. Am. 184, 54–57.
12. Rosenberg K. 1992 The evolution of modern childbirth. Yearb. Phys. Anthropol. 35, 89–124. (doi:10.1002/ajpa.1330350605)
13. Ruff CB, Trinkaus E, Holliday TW. 1997 Body mass and encephalization in Pleistocene Homo. Nature 387, 173–176. (doi:10.1038/387173a0)
14. Cole TJ. 2003 The secular trend in human physical growth: a biological view. Econ. Hum. Biol. 1, 161–168. (doi:10.1016/S1570-677X(02)00033-3)
15. Malina RM. 1990 Research on secular trends in auxology. Anthropol. Anz. 48, 209–227.
16. Dunsworth HM, Warrener AG, Deacon T, Ellison PT, Pontzer H. 2012 Metabolic hypothesis for human altriciality. Proc. Natl Acad. Sci. USA 109, 15 212– 15 216. (doi:10.1073/pnas.1205282109)
17. Bergmann C. 1847 U¨ ber die Verha¨ltnisse der wa¨rmeo¨konomie der Thiere zu ihrer Gro¨sse. Go¨ttinger Studien 3, 595–708.
18. Allen JA. 1877 The influence of physical conditions on the genesis of species. Radical Rev. 1, 108–140.
19. Newman MT. 1953 The application of ecological rules to the racial anthropology of the aboriginal New World. Am. Anthropol. 55, 311–327. (doi:10. 1525/aa.1953.55.3.02a00020)
20. Roberts DF. 1953 Body weight, race and climate. Am. J. Phys. Anthropol. 11, 533–558. (doi:10.1002/ ajpa.1330110404)
21. Roberts DF. 1973 Climate and human variability. An Addison-Wesley module in anthropology, No. 34. Reading, MA: Addison-Wesley.
22. Katzmarzyk PT, Leonard WR. 1998 Climatic influences on human body size and proportions: ecological adaptations and secular trends. Am. J. Phys. Anthropol. 106, 483–503. (doi:10. 1002/(SICI)1096-8644(199808)106:4,483::AIDAJPA4.3.0. CO;2-K)
23. Wells JC. 2012 Ecogeographical associations between climate and human body composition: analyses based on anthropometry and skinfolds. Am. J. Phys. Anthropol. 147, 169–186. (doi:10. 1002/ajpa.21591)
24. Ashton KG. 2002 Patterns of within-species body size variation of birds: strong evidence for Bergmann’s rule. Glob. Ecol. Biogeogr. 11, 505–523. (doi:10.1046/j.1466-822X.2002.00313.x)
25. Ashton KG, Feldman CR. 2003 Bergmann’s rule in nonavian reptiles: turtles follow it, lizards and snakes reverse it. Evolution 57, 1151–1163. (doi:10. 1111/j.0014-3820.2003.tb00324.x)
26. Ashton KG, Tracy MC, deQueiroz A. 2000 Is Bergmann’s rule valid for mammals? Am. Nat. 156, 390–415. (doi:10.1086/303400)
27. Paterson JD. 1996 Coming to America: acclimation in macaque body structures and Bergmann’s Rule. Int. J. Primatol. 17, 585–612. (doi:10.1007/ BF02735193)
28. Trinkaus E. 1981 Neanderthal limb proportions and cold adaptation. In Aspects of human evolution (ed. CBS Stringer), pp. 187–224. London, UK: Taylor and Francis.
29. Ruff C. 2002 Variation in human body size and shape. Annu. Rev. Anthropol. 31, 211–232. (doi:10.1146/annurev.anthro.31.040402.085407)
30. Ruff CB. 1994 Morphological adaptation to climate in modern and fossil humans. Yrbk. Phys. Anthropol. 37, 65–107. (doi:10.1002/ajpa. 1330370605)
31. Dobzhansky T, Boesinger E. 1983 Human culture: a moment in evolution. New York, NY: Columbia University Press.
32. Fisher RA. 1930 The genetical theory of natural selection. London, UK: Oxford University Press.
33. Lango Allen H et al. 2010 Hundreds of variants clustered in genomic loci and biological pathways affect human height. Nature 467, 832–838. (doi:10.1038/nature09410)
34. Taal HR et al. 2012 Common variants at 12q15 and 12q24 are associated with infant head circumference. Nat. Genet. 44, 532–538. (doi:10. 1038/ng.2238)
35. Grabowski MW. 2013 Human obstetrics and the evolution of constraints. Evol. Biol. 40, 57–75. (doi:10.1007/s11692-012-9174-7)
36. Kurki HK. 2013 Skeletal variability in the pelvis and limb skeleton of humans: does stabilizing selection limit female pelvic variation? Am. J. Hum. Biol. 25, 795–802. (doi:10.1002/ajhb.22455)
37. Wells JC. 2003 The thrifty phenotype hypothesis: thrifty offspring or thrifty mother? J. Theor. Biol. 221, 143–161. (doi:10.1006/jtbi.2003.3183)
38. Wells JC. 2010 Maternal capital and the metabolic ghetto: an evolutionary perspective on the transgenerational basis of health inequalities. Am. J. Hum. Biol. 22, 1–17. (doi:10.1002/ajhb.20994)
39. Wells JC, Cole TJ. 2002 Birth weight and environmental heat load: a between-population analysis. Am. J. Phys. Anthropol. 119, 276–282. (doi:10.1002/ajpa.10137)
40. Wells JC. 2002 Thermal environment and human birth weight. J. Theor. Biol. 214, 413–425. (doi:10. 1006/jtbi.2001.2465)
41. Kelly RL. 1995 The foraging spectrum. Washington, DC: Smithsonian Institution Press.
42. Aiello LC, Wheeler P. 1995 The expensive-tissue hypothesis—the brain and the digestive-system in human and primate evolution. Curr. Anthropol. 36, 199–221. (doi:10.1086/204350)
43. Holliday MA. 1978 Body composition and energy needs during growth. In Human growth, vol. 2 (eds F Falkner, JM Tanner), pp. 117–139. New York, NY: Plenum.
44. Sellen DW. 2006 Lactation, complementary feeding, and human life history. In The evolution of human life history (eds K Hawkes, RL Paine), pp. 155–196. Santa Fe, NM: School for American Research Press.
45. Stearns SC. 1992 The evolution of life histories. Oxford, UK: Oxford University Press.
46. McCance RA, Widdowson EM. 1956 The effects of chronic undernutrition and of total starvation on growing and adult rats. Br. J. Nutr. 10, 363–373. (doi:10.1079/BJN19560054)
47. Widdowson EM, McCance RA. 1975 A review: new thoughts on growth. Pediatr. Res. 9, 154–156. (doi:10.1203/00006450-197503000-00010)
48. Wells JC, Chomtho S, Fewtrell MS. 2007 Programming of body composition by early growth and nutrition. Proc. Nutr. Soc. 66, 423–434. (doi:10.1017/S0029665107005691)
49. Dick JL. 1922 Rickets: a study of economic conditions and their effects on the health of the nation. London, UK: William Heinemann.
50. Kuzawa CW. 2005 Fetal origins of developmental plasticity: are fetal cues reliable predictors of future nutritional environments? Am. J. Hum. Biol. 17, 5–21. (doi:10.1002/ajhb.20091)
51. Wells JC. 2014 Adaptive variability in the duration of critical windows of plasticity: implications for the programming of obesity. Evol. Med. Public Health 2014, 109–121. (doi:10.1093/emph/eou019)
52. Hill K. 1993 Life history theory and evolutionary anthropology. Evol. Anthropol. 2, 78–89. (doi:10. 1002/evan.1360020303)
53. Trivers RL. 1974 Parent–offspring conflict. Am. Zool. 14, 249–264.
54. Godfray HC, Johnstone RA. 2000 Begging and bleating: the evolution of parent–offspring signalling. Phil. Trans. R. Soc. Lond. B 355, 1581–1591. (doi:10.1098/rstb.2000.0719)
55. Bateson P. 1994 The dynamics of parent–offspring relationships in mammals. Trends Ecol. Evol. 9, 399–403. (doi:10.1016/0169-5347(94)90066-3)
56. Hinde CA, Johnstone RA, Kilner RM. 2010 Parent– offspring conflict and coadaptation. Science 327, 1373–1376. (doi:10.1126/science.1186056)
57. Moore T, Haig D. 1991 Genomic imprinting in mammalian development: a parental tug-of-war. Trends Genet. 7, 45–49. (doi:10.1016/0168- 9525(91)90230-N)
58. Haig D. 1993 Genetic conflicts in human pregnancy. Q. Rev. Biol. 68, 495–532. (doi:10.1086/418300)
59. Wells JC. 2003 Parent–offspring conflict theory, signaling of need, and weight gain in early life. Q. Rev. Biol. 78, 169–202. (doi:10.1086/374952)
60. Haig D. 1999 Genetic conflicts of pregnancy and childhood. In Evolution in health and disease (ed. SC Stearns), pp. 77–90. Oxford, UK: Oxford University Press.
61. Epstein HT. 1973 Possible metabolic constraints on human brain weight at birth. Am. J. Phys. Anthropol. 39, 135–136. (doi:10.1002/ajpa. 1330390114)
62. Barton RA, Capellini I. 2011 Maternal investment, life histories, and the costs of brain growth in mammals. Proc. Natl Acad. Sci. USA 108, 6169–6174. (doi:10.1073/pnas.1019140108)
63. MacKay DF, Smith GC, Dobbie R, Pell JP. 2010 Gestational age at delivery and special educational need: retrospective cohort study of 407 503 schoolchildren. PLoS Med. 7, e1000289. (doi:10. 1371/journal.pmed.1000289)
64. Coates KW, Galan HL, Shull BL, Kuehl TJ. 1995 The squirrel monkey: an animal model of pelvic relaxation. Am. J. Obstet. Gynecol. 172, 588–593. (doi:10.1016/0002-9378(95)90577-4)
65. Coates KW, Gibson S, Williams LE, Brady A, Abee CR, Shull BL, Kuehl TJ. 1995 The squirrel monkey as an animal model of pelvic relaxation: an evaluation of a large breeding colony. Am. J. Obstet. Gynecol. 173, 1664–1669; discussion 1669–70. (doi:10. 1016/0002-9378(95)90407-7)
66. Frank LG, Glickman SE. 1994 Giving birth through a penile clitoris: parturition and dystocia in the spotted hyaena (Crocuta crocuta). J. Zool. 234, 659–690. (doi:10.1111/j.1469-7998.1994. tb04871.x)
67. Leutenegger W. 1982 Encephalization and obstetrics in primates with particular reference to human evolution. In Primate brain evolution: methods and concepts (eds E Armstrong, D Falk), pp. 85–95. New York, NY: Plenum Press.
68. Leary S et al. 2006 Geographical variation in neonatal phenotype. Acta Obstet. Gynecol. Scand. 85, 1080–1089. (doi:10.1080/00016340600697447)
69. Wells JC. 2013 The thrifty phenotype and the hierarchical preservation of tissues under stress. Int. J. Epidemiol. 42, 1223–1227. (doi:10.1093/ije/ dyt130)
70. Hogue CJ, Buehler JW, Strauss LT, Smith JC. 1987 Overview of the National Infant Mortality Surveillance (NIMS) project—design, methods, results. Public Health Rep. 102, 126–138.
71. Bartz S et al. 2014 Severe acute malnutrition in childhood: hormonal and metabolic status at presentation, response to treatment, and predictors of mortality. J. Clin. Endocrinol. Metab. 99, 2128–2137. (doi:10.1210/jc.2013-4018)
72. Yajnik CS, Fall CH, Coyaji KJ, Hirve SS, Rao S, Barker DJP, Joglekar C, Kellingray S. 2003 Neonatal anthropometry: the thin-fat Indian baby. The Pune Maternal Nutrition Study. Int. J. Obes. Relat. Metab. Disord. 27, 173–180. (doi:10.1038/sj.ijo.802219)
73. Hales CN, Barker DJ. 1992 Type 2 (non-insulindependent) diabetes mellitus: the thrifty phenotype hypothesis. Diabetologia 35, 595–601. (doi:10. 1007/BF00400248)
74. Latini G, De Mitri B, Del Vecchio A, Chitano G, Felice C, Zetterstro¨m R. 2004 Foetal growth of kidneys, liver and spleen in intrauterine growth restriction: ‘programming’ causing ‘metabolic syndrome’ in adult age. Acta Paediatr. 93, 1635–1639. (doi:10. 1111/j.1651-2227.2004.tb00855.x)
75. Ruff C. 2010 Body size and body shape in early hominins—implications of the Gona pelvis. J. Hum. Evol. 58, 166–178. (doi:10.1016/j.jhevol.2009. 10.003)
76. Papiernik E, Alexander GR, Paneth N. 1990 Racial differences in pregnancy duration and its implications for perinatal care. Med. Hypotheses 33, 181–186. (doi:10.1016/0306-9877(90)90173-C)
77. Papiernik E, Cohen H, Richard A, de Oca MM, Feingold J. 1986 Ethnic difference in duration of pregnancy. Ann. Hum. Biol. 13, 259–265. (doi:10. 1080/03014468600008431)
78. Mathai M, Thomas S, Peedicayil A, Regi A, Jasper P, Joseph R. 1995 Growth pattern of the Indian fetus. Int. J. Gynaecol. Obstet. 48, 21–24. (doi:10.1016/ 0020-7292(94)02237-2)
79. Tambyraja RL. 1991 The prematurity paradox of the small Indian baby. Indian J. Pediatr. 58, 415–419. (doi:10.1007/BF02750921)
80. Vicedo-Cabrera AM, Iniguez C, Barona C, Ballester F. 2014 Exposure to elevated temperatures and risk of preterm birth in Valencia, Spain. Environ. Res. 134C, 210–217. (doi:10.1016/j.envres.2014.07.021)
81. Mahmood TA, Campbell DM, Wilson AW. 1988 Maternal height, shoe size, and outcome of labour in white primigravidas: a prospective anthropometric study. Br. Med. J. 297, 515–517. (doi:10.1136/bmj.297.6647.515)
82. Sokal D, Sawadogo L, Adjibade A. 1991 Short stature and cephalopelvic disproportion in Burkina Faso, West Africa. Operations Research Team. Int. J. Gynaecol. Obstet. 35, 347–350. (doi:10.1016/ 0020-7292(91)90671-Q)
83. Khunpradit S, Patumanond J, Tawichasri C. 2005 Risk indicators for cesarean section due to cephalopelvic disproportion in Lamphun hospital. J. Med. Assoc. Thai 88(Suppl. 2), S63–S68.
84. Drukker JW, Tassenaar V. 1997 Paradoxes of modernization and material well-being in The Netherlands during the nineteenth century. In Health and welfare during industrialization (eds RH Steckel, R Floud), pp. 331–377. Chicago, IL: University of Chicago Press.
85. Fredriks AM et al. 1998 Nederlandse groeidiagrammen 1997 in historisch perspectief. In De vierde Landelijke Groeistudie (1997) Presenatie niewe groeidiagrammen (ed. JM Wit), pp. 1–13. Leiden, The Netherlands: TNO Preventie en Gezondheit.
86. Harrison KA, Briggs ND, John CT, Memberr MTB, Lolomari DO. 1988 Growth during early teenage pregnancy. Lancet 331, 1226–1227. (doi:10.1016/ S0140-6736(88)92046-6)
87. Holland EL, Cran GW, Elwood JH, Pinkerton JHM, Thompson W. 1982 Associations between pelvic anatomy, height and year of birth of men and women in Belfast. Ann. Hum. Biol. 9, 113–120. (doi:10.1080/03014468200005581)
88. Lukacs JR. 2007 Human biological diversity in ancient India: Dr Irawati Karve and contemporary issues in biological anthropology. In Anthropology for archaeology: proceedings of the Professor Irawati Karve birth centenary seminar (eds SR Walimbe, PP Joglekar, KK Basa), pp. 193–206. Pune, India: Deccan College Post-Graduate and Research Institute.
89. Pan N. 1996 Measurements of the pelvis in Hindu females. J. Anat. 63, 263–266.
90. Pembrey M. 1996 Imprinting and transgenerational modulation of gene expression; human growth as a model. Acta Genet. Med. Gemellol. (Roma) 45, 111–125.
91. Magnus P, Gjessing HK, Skrondal A, Skjærven R. 2001 Paternal contribution to birth weight. J. Epidemiol. Community Health 55, 873–877. (doi:10.1136/jech.55.12.873)
92. Lunde A, Melve KK, Gjessing HK, Skjaerven R, Irgens LM. 2007 Genetic and environmental influences on birth weight, birth length, head circumference, and gestational age by use of population-based parent–offspring data. Am. J. Epidemiol. 165, 734–741. (doi:10.1093/aje/kwk107)
93. Mook-Kanamori DO, van Beijsterveldt CE, Steegers EA, Aulchenko YS, Raat H, Hofman A, Eilers PH, Boomsma DI, Jaddoe VWV. 2012 Heritability estimates of body size in fetal life and early childhood. PLoS ONE 7, e39901. (doi:10.1371/ journal.pone.0039901)
94. Silventoinen K et al. 2003 Heritability of adult body height: a comparative study of twin cohorts in eight countries. Twin. Res. 6, 399–408. (doi:10.1375/ 136905203770326402)
95. Gielen M, Lindsey PJ, Derom C, Smeets HJM, Souren NY, Paulussen ADC, Derom R, Nijhuis JG. 2008 Modeling genetic and environmental factors to increase heritability and ease the identification of candidate genes for birth weight: a twin study. Behav. Genet. 38, 44–54. (doi:10.1007/s10519-007-9170-3)
96. Adkins RM, Somes G, Morrison JC, Hill JB, Watson EM, Magann EF, Krushkal J. 2010 Association of birth weight with polymorphisms in the IGF2, H19, and IGF2R genes. Pediatr. Res. 68, 429–434. (doi:10.1203/PDR.0b013e3181f1ca99)
97. Petry CJ et al. 2005 Common polymorphism in H19 associated with birthweight and cord blood IGF-II levels in humans. BMC Genet. 6, 22. (doi:10.1186/ 1471-2156-6-22)
98. Ishida M et al. 2012 Maternal inheritance of a promoter variant in the imprinted PHLDA2 gene significantly increases birth weight. Am. J. Hum. Genet. 90, 715–719. (doi:10.1016/j.ajhg.2012. 02.021)
99. Horikoshi M et al. 2013 New loci associated with birth weight identify genetic links between intrauterine growth and adult height and metabolism. Nat. Genet. 45, 76–82. (doi:10.1038/ ng.2477)
100. Khong TY, Adema ED, Erwich JJ. 2003 On an anatomical basis for the increase in birth weight in second and subsequent born children. Placenta 24, 348–353. (doi:10.1053/plac.2002.0922)
101. Williams LA, Evans SF, Newnham JP. 1997 Prospective cohort study of factors influencing the relative weights of the placenta and the newborn infant. Br. Med. J. 314, 1864–1868. (doi:10.1136/ bmj.314.7098.1864)
102. Wang N, Tikellis G, Sun C, Pezic A, Wang L, Wells JCK, Cochrane J, Ponsonby A-L, Dwyer T. 2014 The effect of maternal prenatal smoking and alcohol consumption on the placenta-to-birth weight ratio. Placenta 35, 437–441. (doi:10.1016/j.placenta. 2014.04.006)
103. Dharmalingam A, Navaneetham K, Krishnakumar CS. 2010 Nutritional status of mothers and low birth weight in India. Matern. Child Health J. 14, 290–298. (doi:10.1007/s10995-009-0451-8)
104. Hypponen E, Power C, Smith GD. 2004 Parental growth at different life stages and offspring birthweight: an intergenerational cohort study. Paediatr. Perinat. Epidemiol. 18, 168–177. (doi:10. 1111/j.1365-3016.2004.00556.x)
105. Cropley JE, Suter CM, Beckman KB, Martin DIK. 2006 Germ-line epigenetic modification of the murine Avy allele by nutritional supplementation. Proc. Natl Acad. Sci. USA 103, 17 308–17 312. (doi:10.1073/ pnas.0607090103)
106. Kaati G, Bygren LO, Pembrey M, Sjo¨stro¨m M. 2007 Transgenerational response to nutrition, early life circumstances and longevity. Eur. J. Hum. Genet. 15, 784–790. (doi:10.1038/sj.ejhg.5201832)
107. Kaplan H, Lancaster JB, Johnson SE, Bock J. 1995 Does observed fertility maximize fitness among New Mexican men? A test of an optimality model and a new theory of parental investment in the embodied capital of offspring. Hum. Nat. 6, 325–360. (doi:10.1007/BF02734205)
108. Hill K, Kaplan H. 1999 Life history traits in humans: theory and empirical studies. Annu. Rev. Anthropol. 28, 387–430. (doi:10.1146/annurev.anthro. 28.1.397)
109. Wells JC. 2012 Ecological volatility and human evolution: a novel perspective on life history and reproductive strategy. Evol. Anthropol. 21, 277–288. (doi:10.1002/evan.21334)
110. Walton A, Hammond J. 1938 The maternal effects on growth and conformation in Shire horse-Shetland pony crosses. Proc. R. Soc. Lond. B 121, 311–335. (doi:10.1098/rspb. 1938.0029)
111. Batra TR, McAllister AJ, Lee AJ, Lin CY, Roy GL, Vesely JA, Wauthy J, Winter KA. 1983 Body weights and dimensions of pureline and crossline heifers of the Canadian dairy cattle breeding project. Can. J. Anim. Dairy Sci. 63, 511–522. (doi:10.4141/ cjas83-060)
112. Joubert DM, Hammond JA. 1958 A crossbreeding experiment with cattle, with special reference to the maternal effect in South Devon–Dexter crosses. J. Agr. Sci. 51, 325–341. (doi:10.1017/ S0021859600035140)
113. Baten J, Blum M. 2012 Growing tall but unequal: new findings and new background evidence on anthropometric welfare in 156 countries, 1810–1989. Econ. Hist. Dev. Regions 27(Suppl. 1), S66–S85. (doi:10.1080/20780389.2012.657489)
114. Deurenberg P, Deurenberg-Yap M, Guricci S. 2002 Asians are different from Caucasians and from each other in their body mass index/body fat per cent relationship. Obes. Rev. 3, 141–146. (doi:10.1046/j. 1467-789X.2002.00065.x)
115. Wells JC, Sharp G, Steer PJ, Leon DA. 2013 Paternal and maternal influences on differences in birth weight between Europeans and Indians born in the UK. PLoS ONE 8, e61116. (doi:10.1371/journal.pone.0061116)
116. Stanfield KM, Wells JC, Fewtrell MS, Frost C, Leon DA. 2012 Differences in body composition between infants of South Asian and European ancestry: the London Mother and Baby Study. Int. J. Epidemiol. 41, 1409–1418. (doi:10.1093/ije/dys139)
117. Nystrom MJ, Caughey AB, Lyell DJ, Druzin ML, El-Sayed YY. 2008 Perinatal outcomes among Asian-white interracial couples. Am. J. Obstet. Gynecol. 199, 385.e1–385.e5. (doi:10.1016/j.ajog.2008.06.065)
118. Wells JC. 2007 The thrifty phenotype as an adaptive maternal effect. Biol. Rev. Camb. Philos. Soc. 82, 143–172. (doi:10.1111/j.1469-185X.2006.00007.x)
119. Cohen MN, Armelagos GJ. 1984 Palaeopathology and the origins of agriculture. Orlando, FL: Academic Press.
120. Garenne M. 2011 Trends in nutritional status in adult women in sub-Saharan Africa. DHS Comparative Reports 27. Calverton, MD: ICF Macro.
121. Wells JC. 2013 Obesity as malnutrition: the dimensions beyond energy balance. Eur. J. Clin. Nutr. 67, 507–512. (doi:10.1038/ejcn.2013.31)
122. Jang HC, Min HK, Lee HK, Cho NH, Metzger BE. 1998 Short stature in Korean women: a contribution to the multifactorial predisposition to gestational diabetes mellitus. Diabetologia 41, 778–783. (doi:10.1007/s001250050987)
123. Moses RG, Mackay MT. 2004 Gestational diabetes: is there a relationship between leg length and glucose tolerance? Diabetes Care 27, 1033–1035. (doi:10. 2337/diacare.27.5.1033)
124. Koyanagi A, Zhang J, Dagvadorj A, Hirayama F, Shibuya K, Souza JP, Gu¨lmezoglu AM. 2013 Macrosomia in 23 developing countries: an analysis of a multicountry, facility-based, cross-sectional survey. Lancet 381, 476–483. (doi:10.1016/S0140- 6736(12)61605-5)
125. Ceesay SM, Prentice AM, Cole TJ, Foord F, Poskitt EME, Weaver LT, Whitehead RG. 1997 Effects on birth weight and perinatal mortality of maternal dietary supplements in rural Gambia: 5 year randomised controlled trial. Br. Med. J. 315, 786–790. (doi:10.1136/bmj.315.7111.786)
126. Lunn PG, Austin S, Prentice AM, Whitehead RG. 1984 The effect of improved nutrition on plasma prolactin concentrations and postpartum infertility in lactating Gambian women. Am. J. Clin. Nutr. 39, 227–235.
127. Wells JC, Stock JT. 2011 Re-examining heritability: genetics, life history and plasticity. Trends Endocrinol. Metab. 22, 421–428. (doi:10.1016/j. tem.2011.05.006)
128. Price KC, Hyde JS, Coe CL. 1999 Matrilineal transmission of birth weight in the rhesus monkey (Macaca mulatta) across several generations. Obstet. Gynecol. 94, 128–134. (doi:10.1016/S0029- 7844(99)00269-0)
129. Wells JC. 2012 Obesity as malnutrition: the role of capitalism in the obesity global epidemic. Am. J. Hum. Biol. 24, 261–276. (doi:10.1002/ ajhb.22253)
Et pour aller plus loin
Médecine évolutionniste (ou darwinienne)
Depuis quelques années, le problème de l'antibiorésistance, les progrès de la génomique, la redécouverte du microbiote et la prise en charge de maladies au long cours, nécessitent l'introduction d'une pensée évolutionniste dans la réflexion clinique.
Le premier diplôme universitaire intitulé "Biologie de l'évolution et médecine" a été mis en place à la faculté de Lyon en 2016.
Vous aimerez aussi...
Mutation et sélection des cellules-souche tissulaires comme cause de vieillissement - Il existe une littérature abondante sur l'évolution et le vieillissement destinée à expliquer [...]
Pourquoi les humains ont perdu leur fourrure ? - Les théoriciens de l'évolution ont avancé de nombreuses hypothèses sur les raisons pour [...]
Adaptation au pôle Nord - Sélection environnementale au cours de la dernière période glaciaire sur la transmission de la [...]
Douleur et empathie - Dans une perspective évolutionniste, l’expression faciale de la douleur est un mode de [...]
Microbiotes : quelques idées reçues à rectifier - Précisons d’abord la différence entre un microbiote toujours spécifique à un organe [...]
Vous aimerez aussi ces humeurs...
Science impossible du dépistage - Actuellement, les dépistages « organisés » ou « de masse » des cancers – donc sans [...]
Curieuse extension de l'effet placebo - D’après les données de la science indépendante, les traitements médicamenteux [...]
L'erreur n'est pas toujours le médicament - Le Thalidomide® et le Distilbène® font partie de ces gros scandales de l’histoire de [...]
Dépistage de la normalité - En 2014, résumant les dernières années de recherche, George Johnson osait affirmer « Le [...]
Grossesse, tabac et autres drogues - Nul ne peut ignorer que fumer pendant la grossesse est très nocif pour l’embryon, le fœtus, [...]
Livres de biologie et médecine évolutionnistes
Le temps des pères - Sarah Blaffer Hrdy ▪ La Découverte, août 2025 Sarah Hrdy est connue pour avoir démontré [...]
Du bon sens dans notre assiette - Anthony Berthou ▪ Actes Sud, février 2023 Les ouvrages sur la nutrition abondent, et [...]
Comment nous sommes devenus ce que nous sommes - David Reich ▪ Quanto, 2019 La science de l'ADN ancien, née dans les années 2000, a [...]
Destinées improbables
Le hasard, la nécessité et l'avenir de l'évolution - Jonathan B Losos ▪ La Découverte, 2021
Ce livre aborde trois aspects de la biologie de [...]
L'origine des troubles mentaux - Randolph Nesse ▪ Markus Haller, 2021 Randolph Nesse et George Williams ont été les premiers [...]
La phrase biomédicale aléatoire
A l'aide des sciences expérimentales actives, l'homme devient un inventeur de phénomènes, un véritable contremaître de la création; et l'on ne saurait, sous ce rapport, assigner de limites à la puissance qu'il peut acquérir sur la nature, par les progrès futurs des sciences expérimentales.
Maintenant reste la question de savoir si la médecine doit demeurer une science d'observation ou devenir une science expérimentale. Sans doute la médecine doit commencer par être une simple observation clinique. Ensuite, comme l'organisme forme par lui-même une unité harmonique, un petit monde (microcosme) contenu dans le grand monde (macrocosme), on a pu soutenir que la vie était indivisible et qu'on devait se borner à observer les phénomènes que nous offrent dans leur ensemble les organismes vivants sains et malades, et se contenter de raisonner sur les faits observés. Mais si l'on admet qu'il faille ainsi se limiter, et si l'on pose en principe que la médecine n'est qu'une science passive d'observation, le médecin ne devra pas plus toucher au corps humain que l'astronome ne touche aux planètes. Dès lors l'anatomie normale ou pathologique, les vivisections, appliquées à la physiologie, à la pathologie et à la thérapeutique, tout cela est complètement inutile. La médecine ainsi conçue ne peut conduire qu'à l'expectation et à des prescriptions hygiéniques plus ou moins utiles; mais c'est la négation d'une médecine active, c'est-à-dire d'une thérapeutique scientifique et réelle.
― Claude Bernard
Vous aimerez aussi ces humeurs...
Mon répondeur chez le psychiatre - Les répondeurs automatiques qui vous donnent les choix 1, 2 ou 3, après avoir tapé [...]
Cardiologie et plomberie environnementales - Chacun choisit sa médecine non seulement en fonction des maux qu’il vit, mais aussi en [...]
Nouvelle boucle du tabac - Importé par les explorateurs de l’Amérique, le tabac fut l’un des premiers traitements [...]
Cancer des prix du cancer - Depuis le début de l’année 2016, les médias relatent régulièrement des pétitions et [...]
La mort est plurifactorielle, même en période de crise - Guerres, famines, épidémies ou chocs climatiques provoquent des pics de mortalité. Lors des [...]